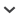First records of spiders and harvestmen (Arachnida: Araneae, Opiliones) for Schleswig-Holstein (Germany) since 2010 with remarks on endangerment status. In the years 2004 to 2017 the author has recorded 25 spider species and one harvestman newly for Schleswig-Holstein. The unpublished records since 2010 are presented for the first time: 2010: Araniella inconspicua (Simon, 1874); 2011: Hahnia ononidum Simon, 1875; 2012: Centromerus incilium (L. Koch, 1881); 2013: Mermessus trilobatus (Emerton, 1882); 2014: Anelasmocephalus cambridgei Westwood, 1874, Glyphesis servulus (Simon, 1881), Micrargus apertus (O. P.-Cambridge, 1871) and the lost harvestman Lacinius horridus (Panzer, 1794); 2015: Cheiracanthium campestre Lohmander, 1944, Improphantes decolor (Westring, 1861), Sibianor larae Logunov, 2001; 2017: Clubiona leucaspis (Simon, 1932). In addition, remarks on endangerment status with respect to earlier records since 2004 are provided.
Der Autor untersucht in seiner Freizeit die Spinnenfauna Schleswig-Holsteins. Seit 2011 wurde die Nachsuche im Rahmen des durch das Bundesforschungsministerium geförderte Projekt „German Barcode of Life” (GBOL) intensiviert. Der Autor arbeitet hier mit dem Zoologischen Forschungsmuseum Alexander König (ZFMK, Bonn) zusammen, wo die für dieses Projekt erfassten Individuen unter der Probenbezeichnung ZFMK-TIS (plus Nummer) archiviert werden. Seit 2017 ist der Autor vom Ministerium für Energiewende, Landwirtschaft, Umwelt, Natur und Digitalisierung (MELUND) des Landes Schleswig-Holstein offiziell mit der Aufnahme von Verbreitungsdaten für eine Rote Liste beauftragt.
Material und Methoden
Bis 2011 kamen überwiegend Streifkescher und Klopfschirm zum Einsatz. In der Folgezeit wurde überwiegend Gesiebe untersucht. Im Frühjahr 2015 wurde das Erfassungsequipment durch einen Vegetationssauger ergänzt. An wenigen Standorten kamen auch Bodenfallen zum Einsatz. Abkürzungen der Nachweismethoden (vgl. auch Tab. 1): BF: Bodenfalle, GB: Gesiebebox, GS: Gesiebe, HF: Handfang, KS: Klopfschirm, SK: Streifkescher, VS: Vegetationssauger.
Die angegebenen Koordinaten sind gegliedert in N/O; es gilt das Kartendatum „WGS 84”, andernfalls wird „Potsdam” hinter den Koordinaten angegeben.
Die Tiere wurden nach klassischen morphologischen Merkmalen mit binokularen Mikroskopen bestimmt; Die Bestimmung erfolgte mit Roberts (1987, 1995), den Bestimmungsseiten der Uni Bern (Nentwig et al. 2017) und mit dem AraGes-Wiki (2017). Für das GBOL-Projekt noch fehlende Arten wurden dem ZFMK zwecks Barcoding zugeführt.
Die verwendeten Häufigkeitsangaben (vgl. auch Tab. 1) folgen im Prinzip dem Schema der ersten Roten Liste (Reinke et al. 1998) mit dem Unterschied, dass nicht die Individuen gezählt werden, sondern Nachweise pro Jahr, um Fehleinschätzungen durch höhere Abundanzen zu vermeiden (zwei Nachweise an unterschiedlichen Daten am selben Ort gelten so als zwei Nachweise - unabhängig von der Individuenzahl): 1–2 Nachweise: extrem selten (es), 3–9 Nachweise: sehr selten (ss), 10–20 Nachweise: selten (s), 21–100 Nachweise: mäßig häufig (mh), 101–200 Nachweise: häufig (h) und mit mehr als 200 Nachweisen: sehr häufig (sh). Für alle hier angegebenen Erstnachweise werden aktuelle Gefährdungseinschätzungen gemäß den aktuellen Vorgaben des Bundesamtes für Naturschutz (BfN) (Ludwig et al. 2009) vorgenommen.
In Tabelle 1 werden neben Angaben zu besiedelten Biotoptypen, Straten, Verbreitung und Gefährdung in Schleswig Holstein (Lemke et al. 2013, für mehrere Arten aktualisiert), die Vorkommen und die Gefährdung (soweit vorhanden) in den Nachbarbundesländern Niedersachsen (Nds: Finch 2004) und Mecklenburg-Vorpommern (MV: Martin 2012) sowie in Deutschland (DE: Blick et al. 2016, Muster et al. 2016) und Dänemark (DK: Scharff & Gudik-Sorensen 2011, Enghoff et al. 2014) angegeben. Dabei ist zu berücksichtigen, dass die niedersächsische Rote Liste noch nicht nach der einheitlichen Methodik des BfN (Ludwig et al. 2009) erstellt wurde; die Gefährdungseinstufungen Mecklenburg-Vorpommerns und Schleswig-Holsteins sind dadurch nur bedingt mit denen aus Niedersachsen vergleichbar. Die Rote Liste Niedersachsens unterscheidet zwischen Tiefland und Hochland; in Tabelle 1 werden vorzugsweise die Daten für das Tiefland angegeben. Sofern keine Angaben für das Tiefland vorliegen, gilt die Bewertung für gesamt Niedersachsen. Neuere Nachweise, welche noch nicht in den Roten Listen berücksichtigt sind, werden als ”n” (neu) in Tabelle 1 geführt.
Die Nomenklatur für richtet sich nach dem WSC (2017) und dem AraGes-Wiki (2017). Die Verbreitungsangaben im Text beziehen sich auf den AraGes-Atlas (2017).
Tab. 1:
Erstnachweise von Webspinnen und Weberknechten in Schleswig-Holstein
Tab. 1: First records of spiders and harvestmen in Schleswig-HolsteinStratum: BO = Boden, bodennahe Vegetation, Streu; NV = niedrige Vegetation; BS = Baum- und Strauchschicht Biotope: Dü = Dünen, Hei = Heide, Gt = trockenes Grünland, Kni = Wallhecken (Knicks), Mo = Moore und deren Randbereiche, Tro = Trockenrasen, Wa = Trockene bis frische Wälder, Syn = in oder an Gebäuden (synanthrop) Methoden, Häufigkeit SH, Rote Listen (RL) und Checklisten (Check): siehe Text Einschätzung SH = neue RL-Einschätzung für Schleswig-Holstein Rote-Liste-Kategorien: 1 = vom Aussterben bedroht, 2 = stark gefährdet, 3 = gefährdet, G = Gefährdung unbekannten Ausmaßes, R = extrem selten, V = Vorwarnliste, D = Daten unzureichend, nb = nicht bewertete Neobiota, n = neu, * = vorkommend, nicht gefährdet, - kein Nachweis vorhanden Checkliste DK (Dänemark): X = vorkommend, - kein Nachweis vorhanden

Ergebnisse
Anelasmocephalus cambridgei Westwood, 1874
(Opiliones, Trogulidae)
Nachweis eines Individuums (Geschlecht und Reifegrad nicht näher bestimmt) am 17.04.2014 in Laubstreugesiebe im Ubergangsbereich von Buchenwald zu Fichtenforst im Bliestorfer Wald (1 Ind., 53°46,396/10°39,470, ZFMKTIS 2524797), südlich Lübecks im Landkreis Herzogtum Lauenburg. Der Bliestorfer Wald liegt auf Moorgrund einer ehemaligen Feuchtheide und ist von zahlreichen entwässernden Gräben durchzogen. Für die Fangzeiträume 11.01.-30.01.2015 und 14.03.-29.03.2015 wurde an derselben Stelle jeweils ein weiteres Exemplar mittels Bodenfallen erfasst. Am 10.06.2017 gelang etwa 14 km südwestlich des ersten Fundortes im FFH-Gebiet Koberger Moor ein weiterer Nachweis mittels Vegetationssauger (2 Ind., 53,651955710,510431°, ZFMK-TIS 2602030 & ZFMK-TIS 2602031) in einem bewaldeten Moor.
Anelasmocephalus cambridgei lebt in Laubwäldern in der oberen Bodenschicht, im Falllaub und unter morschem Holz und Steinen (Wijnhoven 2005). In Schleswig-Holstein ist sie bislang nur in der Bodenstreu von nassen bis relativ feuchten Wäldern nachgewiesen. Diese Art ist die einzige der Gattung Anelasmocephalus, die in Deutschland vorkommt. Ihr Vorkommen wurde zuletzt im 19. Jahrhundert für die norddeutsche Tiefebene an der Elbe bei Hamburg publiziert (Kraepelin 1896). Die vorliegenden Nachweise markieren die nördlichsten Verbreitungspunkte in Deutschland (vgl. Abb. 1). Für Schleswig-Holstein muss diese Art mit nur vier Nachweisen als sehr selten eingestuft werden. Eine Gefährdungslage ist nicht zu erkennen, woraus die Gefährdungseinstufung ”ungefährdet„ resultiert.
Habitus und Feldkennzeichen: Männchen 2,6-3,5 mm, Weibchen 3,2-3,9 mm, schlank tropfenförmig und flauschig behaart (Martens 1978). Die Gelenkhäute der Beine erscheinen beim Mikroskopieren lilafarben.
Abb. 1:
Verbreitung von Anelasmocephalus cambridgei in Deutschland
Fig. 1: Distribution of Anelasmosephalus cambridgei in Germany

Araniella inconspicua (Simon, 1874)
(Araneae, Araneidae)
Im Mai 2010 gelang der Nachweis zweier Tiere im Randbereich des Großen Deepenmoors. Das Große Deepenmoor ist ein Teilbereich des 960 ha großen Walgebietes Lauer Holz am östlichen Rand des Lübecker Stadtgebietes (1♂ & 1♀, 53°52,60′/10°45,90′ Potsdam). Der Fundort hat Waldrandcharakter. Das Moor besteht aus einer Feuchtwiese und zwei Wasserflächen, welche durch eine Bruchwaldzone verbunden sind. Der Nachweis gelang mit dem Streifkescher auf einer Wiese in der Nähe überhängender Zweige einer großen Eiche.
Im selben Jahr 2010 konnte der Autor im Rahmen des GEO-Tages im nördlich der Elbe gelegenen niedersächsischen Preten (Amt Neuhaus) zwei Weibchen von A. inconspicua von Eichenzweigen klopfen (2 ♀♀,53,317124V10,910028°) (Lemke 2010). Diese standen zwischen Wald und einem Feuchtgebiet.
Bei A. inconspicua handelt es sich um eine wärmeliebende Art, welche Eichen und Kiefern bevorzugt (Buchholz & Kreuels 2005). Weitere Funde dieser Art gelangen in Schleswig-Holstein bislang nicht. Allerdings gilt A. inconspicua europaweit als sehr selten und wurde stets nur in geringer Individuenzahl an nur wenigen Orten nachgewiesen (Sacher 1984).
Das festgestellte Vorkommen von A. inconspicua wurde in der aktuellen Ausgabe der Roten Liste der Spinnen Schleswig-Holsteins (Lemke et al. 2013) berücksichtigt und die Einstufung D (Datenlage defizitär) vergeben. Diese Einstufung war nicht konform mit der Definition des BfN und muss auf ”R„ korrigiert werden.
Centromerus incilium (L. Koch, 1881)
(Araneae, Linyphiidae)
Im August des Jahres 2012 erfolgten an mehreren, teilweise relativ weit voneinander entfernten Orten Nachweise dieser Art: Negernbötel (3♀♀ & 3♂♂, 53,9897V10,26085° Potsdam), Büchener Sander südöstlich von Göttin (2$$, 53,8603710,7126° Potsdam) und Barker Heide (8♀♀ & 4♂♂, 53,9171710,1532° Potsdam) - diese stammen alle aus Heiden bzw. deren Randbereichen, Bliestorfer Wald (1♂, 53,7739710,5826°, 13.12.2014, Mischwald), NSG Gronauer Heide (2♀♀, 53,8108710,7352° und 53,8137710,7243° Potsdam, Sandheide), NSG Pantener Moorweiher (2♀♀, 53,6685710,6345°). Alle Nachweise stammen aus Bodennähe (Laubstreu, bodennahe Vegetation, Moospolster).
Als Lebensraum wird in der Literatur angegeben: Lebt in trockeneren Laub- und Nadelwäldern (Platen & von Broen 2002) und kommt im Moos von Wäldern und Waldrändern unterschiedlichen Feuchtigkeitsgrades vor (Nentwig et al. 2017).
Aus Mecklenburg-Vorpommern existieren Nachweise seit den 1960er Jahren in größeren zeitlichen Abständen (AraGes-Atlas 2017). Für Schleswig-Holstein sind die Nachweise auf den südöstlichen Landesteil begrenzt. Das Verbreitungsgebiet in Deutschland ist relativ groß. Nach der zeitigem Kenntnisstand ist diese Art für Schleswig-Holstein als sehr selten, aber ungefährdet einzustufen.
Cheiracanthium campestre Lohmander, 1944
(Araneae, Eutichuridae)
Diese Art wurde am 10.05.2015 im für die Öffentlichkeit gesperrten nördlichen Teil des Naturschutzgebietes ”Gronauer Heide und Gronauer Moor„ auf einer der letzten noch erhaltenen Sandheideflächen mit dem Vegetationssauger erfasst (1♂, 53°48,816/10°43,704 Potsdam, VS).
Schikora (2015) gibt für diese selten nachgewiesene Art an: Trockene und offene Lebensräume. Nach der Roten Liste Deutschlands ist sie selten und gefährdet (Blick et al. 2016). C. campestre wurde in den 1970er Jahren erstmals im nordöstlichen Raum Deutschlands erfasst, und es kristallisierte sich mit den Jahren ein Verbreitungsgebiet zwischen der rheinischen Tiefebene und dem östlichen Mecklenburg-Vorpommern und Brandenburg heraus (AraGes-Atlas 2017, vgl. Abb. 2). Mit nur einem Nachweis ist die Art in Schleswig-Holstein extrem selten (”R„).
Abb. 2:
Verbreitung von Cheiracanthium campestre in Deutschland
Fig. 2: Distribution of Cheiracanthium campestre in Germany

Clubiona leucaspis (Simon, 1932) (Araneae, Clubionidae)
Am 24.05.2017 gelang im Naturschutzgebiet ”Hakendorfer Wälder„ (Herzogtum Lauenburg) auf einer zwischen zwei Waldstücken gelegenen Feuchtwiese der Nachweis mittels Vegetationssauger in bodennaher Vegetation (1♂, 53,576491710,841929°, ZFMK-TIS 2599791).
Einige Nachweise der nach Genitalmerkmalen für beide Geschlechter sehr ähnlichen, aber an trockene und sandige Lebensräume gebundenen Clubiona genevensis sind fehlbestimmte Clubiona leucaspis (Blick in litt., Kielhorn 2013). Allerdings lässt sich C. leucaspis zumindest in Deutschland an einem pigmentfreien Oval im hinteren Bereich des Opisthosomas bereits im Gelände gut identifizieren. Die Art ist an Holz gebunden und kann mit Baumeklektoren und Klopfschirm nachgewiesen werden. Der Nachweis auf einer Feuchtwiese bildet damit eher eine Ausnahme.
Dieser Nachweis muss als bedeutend herausgestellt werden, weil es sich um eine wärmeliebende Art handelt, deren Verbreitungsraum in Deutschland ähnlich dem von Cheiracanthium punctorium (Eutichuridae) nur auf besonders warme Gegenden am Mittelrhein (zwischen Karlsruhe und Mainz - in Baden-Württemberg ist sie extrem selten, Nährig et. al 2003) und Untermain (Frankfurt/Main bis Unterfranken) sowie Berlin und Brandenburg (in Berlin mäßig häufig, Kielhorn 2017) begrenzt war (Abb. 3). In Deutschland wurde die ursprünglich aus Südeuropa stammende Art erstmals 1994 in Baden-Württemberg nachgewiesen (Leist 1994). Daher ist der aktuelle Nachweis als erster Beleg für eine tatsächlich klimatisch bedingte Ausbreitung nach Schleswig-Holstein zu bewerten. 2006 wurden bereits erste Anzeichen für eine Arealausweitung durch Nachweise in der Colbitz-Letzlinger Heide, Landkreis Börde, Sachsen-Anhalt (TK 3536 und 3636) festgestellt (Kielhorn 2013, in Abb. 3 als rote Punkte). Für Mecklenburg-Vorpommern ist ein Vorkommen zu vermuten, aber der entsprechende Nachweis steht noch aus. Dieser hängt vornehmlich von der Intensität der Untersuchung arboricoler Lebensräume mit geeigneten Methoden ab.
Mit nur einem Nachweis ergibt sich die Einstufung als ”R„. In der aktuellen Roten Liste für Deutschland ist die Art als selten und ungefährdet gelistet (Blick et al. 2016).
Abb. 3:
Verbreitung der wärmeliebenden Art Clubiona leucaspis in Deutschland. Pinkfarbener Stern: Schleswig-Holstein 2017, rote Punkte: Sachsen-Anhalt 2006.
Fig. 3: Distribution of the thermophilic species Clubiona leucaspis in Germany. Pink star: Schleswig-Holstein 2017, red dots: Saxony-Anhalt 2006.

Glyphesis servulus (Simon, 1881) (Araneae, Linyphiidae)
Der Erstnachweis für Schleswig-Holstein gelang in feuchter bis nasser Streu eines Erlenbruchwaldes am Rand (aber außerhalb) des Lübecker Naturschutzgebietes Schellbruch (2♂♂ 26.03.2014, 53,7733VIO,6578°). In der Laubstreu im Randbereich einer Feuchtwiese gelang im April 2015 der Nachweis eines Weibchens derselben Art (ZFMK-TIS 19138 & Coll. Lemke Box 6 #52).
Diese europaweit selten nachgewiesene Art lebt in feuchtem Detritus der Wälder, in Schilfröhricht und im Moos der Moore (Nentwig et al. 2017). Aktuelle Daten sprechen für eine mögliche adulte Überwinterung und eine Aktivität ab dem zeitigen Frühjahr: Männchen von März bis Juli, Maximum im April; Weibchen von April bis Oktober, Maximum im Juli (Blick 2012).
Aufgrund der insgesamt zwei Nachweise muss die Art für Schleswig-Holstein als extrem selten (”R„) bewertet werden.
Hahnia ononidum Simon, 1875 (Araneae, Hahniidae)
Der Erstnachweis für Schleswig-Holstein erfolgte in Laubstreugesiebe am Rand eines Mischwaldes der Ratekauer Tannen (1♀, 09.10.2011, 53,9333710,7539° Potsdam, Coli. Lemke Box 4#43). Weitere Nachweise folgten am 16.03.2012 (3♀♀ & 3♂♂, Coll. Lemke Box 4 #78) und am 07.04.2013 in der Laubstreu einer sonnenexponierten Wallhecke bei Groß Parin (1♂, ZFMK-TIS 7105, 53,9495710,7062° Potsdam). Beide Fundorte liegen nördlich von Lübeck. 2014 erfolgte erstmals ein Nachweis im südlicheren Landesteil: Am 01.11.2014 in Laubstreugesiebe im Naturschutzgebiet ”Pantener Moorweiher und Umgebung„ (1♀, 53,6540710,6422°, ZFMK-TS 2538163, GS).
Für ganz Deutschland wird diese Art als mäßig häufig angegeben (Blick et al. 2016). DaH. ononidum sich über mehrere Jahre als wiederholt auffindbar erwies, ist davon auszugehen, dass sie ein fester Faunenbestandteil Schleswig-Holsteins ist. Diese Art ist für dieses Bundesland als sehr selten, aber ungefährdet einzustufen.
Abb. 4:
Verbreitung von Improphantes decolor in Deutschland
Fig.4: Distribution of Improphantes decolor in Germany

Improphantes decolor (Westring, 1861)
(Araneae, Linyphiidae)
Am 19.09.2015 gelang der Nachweis in einer kleinen Heidefläche entlang eines Feldweges südöstlich von Göttin in Eichenlaubstreu (1♀, 53,5253710,7095°, ZFMK-TIS 2558676). Die Richtigkeit der Bestimmung wurde durch das ZFMK genetisch bestätigt (Rulik in litt.).
Diese Art ist deutschlandweit ausschließlich im Nordosten von der Weser bis zur polnischen Grenze verbreitet (Abb. 4).
Palmgren (1975) gibt als Habitatansprüche an: Trockene Wiesen und Grasstreifen; dort in Grasbulten und unter Steinen. Thaler (1986) ergänzt: Offene Rasen und Weideflächen. Die kleine Heidefläche des Fundortes liegt unmittelbar am Rand einer kurzrasigen trockenen Rinderweide.
Lacinius horridus (Panzer, 1794) (Opiliones, Phalangiidae)
Am 23.08.2014 wurde die Art in der Bliestorfer Heide im Bodenstreugesiebe nachgewiesen. Der Fund wurde im eher trockenen Bereich der Feuchtheide im Grenzbereich der Heide zu einer auf rohem Boden stehenden Kieferngruppe gemacht (1 Ind., 53,7883710,5855°, ZFMK-TIS 2538129). Geschlecht und Reife des Tieres wurden nicht bestimmt.
Die Bliestorfer Heide liegt eingebettet im Bliestorfer Wald südlich Lübecks zwischen Groß Schenkenberg und Bliestorf. Es handelt sich um eine Feuchtheide auf Moorboden innerhalb des Lübecker Beckens (Buch & Haardt 1956); nach dem Krieg wurde im Gebiet aufgeforstet, so dass heute nur noch 5 ha Heidefläche vorhanden sind (Degener in litt.).
Der thermophile L. horridus liebt trocken-warme unbeschattete Habitate (Martens 1978). Feldkennzeichen: Starke Bestachelung der Beine und des Körpers und dadurch unverwechselbar (Abb. 5).
Nachweis-Historie: Von Kraepelin (1896) wurden für L. horridus zwei Fundorte in Schleswig-Holstein publiziert: Bad Oldesloe (leg. Sonder) und ein Nachweis ohne nähere Fundortangabe (leg. Bösenberg). In der Sammlung des Senckenberg Museums (Arachnologie SMF) werden ebenfalls zwei Funde genannt: Bad Oldesloe (7 juv., anonym, undatiert, Katalognummer 9800705-RI/705-61) und Lohberge (5 adulte, anonym, undatiert, Katalognummer 9800703-RI/703-61) (SESAM 2017). Da für diese beiden Nachweise die Art noch unter dem Synonym Lacinius hispidus determiniert wurde, ist anzunehmen, dass es sich um ähnlich alte Funde handelt, wie die von Kraepelin (1896) genannten. Der vorliegende Nachweis ist also ein Wiederfund nach 118 Jahren.
Dies ist ein seltener Fall, bei dem man für Arachniden eine langfristige (negative) Bestandsentwicklung angeben könnte. Allerdings fehlen Nachweise zwischen 1896 und 2014 und kann eine kurzfristige Bestandsentwicklung nicht benannt werden. Es ist davon auszugehen, dass es sich bei L. horridus um eine seit jeher in Schleswig-Holstein sehr selten vorkommende Art (vier Nachweise in der Literatur für das 19. Jahrhundert) handelt, welche aufgrund des massiven Flächenverlustes am Ort des nunmehr einzigen aktuellen Nachweises in der Bliestorfer Heide auf nur noch 1,8 % der Fläche von vor 165 Jahren vom Aussterben bedroht ist. Für die Art geeignete Habitate bei Bad Oldesloe sind dem Autor nicht bekannt und der Fundort ”Lohberge“ konnte nicht lokalisiert werden.
Abb. 5:
Stachliger Zahnäugler (Lacinius horridus). Foto: Arno Grabolle
Fig. 5: Lacinius horridus. Photo: Arno Grabolle

Micrargus apertus (O. P.-Cambridge, 1871)
(Araneae, Linyphiidae)
Erstnachweis für Schleswig-Holstein durch den Fund eines adulten Weibchens bei Wallsbüll (Kreis Schleswig-Flensburg in einem Mischwald auf Nadelzweigen) (1♀, 25.6.2014, 54,7886°47/09,2238°, ZFMK-TIS 2524887); das Genitalpräparat befindet sich in der Sammlung des Autors. Am 26.05.2015 gelang der Nachweis eines adulten Männchens mittels Bodenfalle (14 Tage Standzeit) in einem Fichtenforst am Rand der Bliestorfer Heide (1♂, 53,7877°/10,5876°, ZFMK-TIS 2551885).
Uber die Biologie der Art ist wenig bekannt. Sie wird möglicherweise oft mit der Schwesterart Micrargus herbigradus (Blackwall, 1854) verwechselt (Nentwig et al. 2017).
Deutschlandweit ist M. apertus weit verbreitet, aber nur punktuell nachgewiesen (AraGes-Atlas 2017). Die Art kommt in Schleswig-Holstein im Norden (Flensburg Wallsbüll) und im Südosten (Groß Schenkenberg) vor. Trotz der weiten Verbreitung ergibt sich hier eine Einstufung als „R“.
Mermessus trilobatus (Emerton, 1882)
(Araneae, Linyphiidae)
Seit dem Erstnachweis von Mermessus trilobatus für Schleswig-Holstein am 29.04.2013 wurde diese Art an einer Vielzahl von Standorten Schleswig-Holsteins nachgewiesen; eine Zusammenfassung aller Nachweise für Schleswig-Holstein befindet sich in Tabelle 2. Am 10.6.2017 konnte im Nordwesten des Landes eine mit Rindern beweidete vor etwa fünf Jahren entwaldete Binnendüne bei Lütjenholm (ca. 24 km südlich der Grenze zu Dänemark) untersucht werden. Dort konnten zwei Tiere nachgewiesen werden (1♂ & 1♀, 54,680049709,011212°). Das Vorkommen im Norden war vom Autor auch erwartet worden.
Mermessus trilobatus stammt ursprünglich aus Nordamerika und ist in den USA von der West- bis zur Ostküste weit verbreitet. Dort lebt M. trilobatus vor allem in bodennaher Vegetation (Millidge 1987). Die Art wurde sogar innerhalb fleischfressender Kannenpflanzen nachgewiesen (van Helsdingen 1982) und bezeugt damit eine besondere Anpassungsfähigkeit.
In Deutschland wurde M. trilobatus erstmals 1979 im TK 7911 in Breisach am Rhein nachgewiesen (Kobel-Lemparski 1987). Man geht davon aus, dass diese Art durch amerikanische Truppen nach Deutschland eingeschleppt wurde (Millidge 1987). Seither breitet sich M. trilobatus in Europa aus und wurde bis jetzt in vielen europäischen Ländern nachgewiesen: Großbritannien, Frankreich, Belgien, Niederlande, Italien, Schweiz, Österreich, Slowenien, Kroatien, Ungarn, Tschechien, Slowakei, Polen, Ukraine (Nentwig et al. 2017, Hirna 2017) und seit 2014 an vier Standorten auf Festland und Inseln auch in Dänemark (Lissner in litt.).
In Schleswig-Holstein wurde M. trilobatus bislang ausschließlich in Offenlandhabitaten nachgewiesen. Sowohl in Feuchtland, als auch in Trockenbiotopen; dabei in Feuchtland stets mit höherer Individuenzahl als an Trockenstandorten. Im AraGes-Atlas (2017) werden 7,5 % Waldstandorte genannt (auf Basis von 264 nachgewiesenen Individuen). In Mecklenburg-Vorpommern wurde sie erstmals 2012 festgestellt (Martin 2013).
Phänologie: M. trilobatus tritt ganzjährig auf (Nentwig et al. 2017). In Schleswig-Holstein wurde diese Art ebenfalls zu allen Jahreszeiten nachgewiesen. Die Nachweisdichte ist zunehmend. Da die Ausbreitung auf Einschleppung beruht, stellt sich die Frage nach einer Gefährdung nicht. Es stellt sich eher die Frage, ob M. trilobatus eine bislang leere Nische besetzt oder andere Arten verdrängt.
Für Schleswig-Holstein sind bis dato 19 Nachweise bekannt und damit ist die Art eigentlich als selten einzustufen. Der Nachweistrend zeigt aber an, dass sich die Nachweise noch mindestens auf ”mäßig häufig„ (21–100 Nachweise) verdichtet werden (siehe Tabelle 2). Mermessus trilobatus ist als mäßig häufig und ungefährdet einzustufen. 2013: 3 Nachweise, 2014: 0 Nachweise, 2015: 2 Nachweise, 2016: 6 Nachweise, 2017: 11 Nachweise.
Sibianor larae Logunov, 2001 (Araneae, Salticidae)
Am 10.05.2015 im nördlichen Teil der Gronauer Heide (am selben Tag und im selben Gebiet wie Cheiracanthium campestre, siehe oben) auf zwei 550 m Luftlinie voneinander entfernt liegenden, durch Sukzession vergrasten Heideflächen erfasst (2♂, 53,8136710,7284° Potsdam, ZFMK-TIS 2551878).
Sibianor larae ist dabei wahrscheinlich kein echter Erstnachweis für Schleswig-Holstein, da diese Art erst 2001 von der auch für Schleswig-Holstein gelisteten sehr ähnlichen Art S. aurocinctus getrennt wurde (Logunov 2001). Es ist also wahrscheinlich, dass die bisherigen Nachweise von S. aurocinctus tatsächlich Nachweise von S. larae sind, da S. aurocinctus seither in Schleswig-Holstein nicht nachgewiesen wurde. Die Rote Liste (Lemke et al. 2013) führt S. aurocinctus als sehr selten mit der Einstufung D (Gefährdung unbekannten Ausmaßes). Es muss sich in der Zukunft zeigen, ob sich S. aurocinctus nachweisen lässt.
Eine Überprüfung älterer Funde hat wenig Klärungspotential, da sich beide Arten hauptsächlich durch die Färbung der Patella des 1. Beinpaars unterscheiden lassen. Da ältere Alkoholpräparate ausbleichen, steht dieses Merkmal nicht mehr zur Verfügung.
Es wurde in den letzten Jahren nur ein Nachweis über S. aurocinctus 2014 auf einer Ackerbrache bei Langenlehsten im südöstlichen Landesteil geführt (1♂, 53,4859710,7276°, ZFMK-TIS 19147). Dieser wird jedoch trotz Zweitgutachten vom ZFMK genetisch bezweifelt und gehört möglicherweise tatsächlich auch S. larae an. In Tabelle 1 wird daher für S. larae die Nachweiszahl mit 2-3 angegeben. Nach derzeitigem Nachweisstand ist der Status ”sehr selten„ aber ungefährdet anzunehmen.
Tab. 2:
Nachweise von Mermessus trilobatus in Schleswig-Holstein
Tab. 2: Records of Mermessus trilobatus in Schleswig-Holstein
Methode: GS = Gesiebe, BF = Bodenfalle, VS = Vegetationssauger

Erkenntnisstand zu den bisher publizierten Erstnachweisen seit 2004
Aculepeira ceropegia (Walckenaer, 1802)
(Araneae, Araneidae)
Erstnachweis für Schleswig-Holstein im Jahr 2004. Danach folgten bis 2007 insgesamt 17 Nachweise, welche sich auf den südöstlichen Landesteil konzentrierten (Lemke 2008). In der aktuellen Roten Liste wird die Art als mäßig häufig und ungefährdet eingestuft (Lemke et al. 2013). Nach 2007 rissen die Nachweise zunächst ab. Die Art wurde erst wieder 2014 in Sarnekow (bei Gudow) nachgewiesen (2 juv., 27.07.2014, 53,547304710,749976°, ZFMK-TIS 2534443).
Diese eurytope Freiflächenart lebt in allen unbewaldeten Lebensräumen unabhängig von der Feuchtigkeit (Platen & von Broen 2002). Damit ist ein Verschwinden durch Zerstörung spezifischer Biotope nicht wahrscheinlich und eine Gefährdung daher nicht anzunehmen. Sie ist trotz schwankender Nachweisdichte weiterhin als ungefährdet anzusehen.
Araneus angulatus Clerck, 1757 (Araneae, Araneidae)
Die Art wurde in Schleswig-Holstein erstmals 2004 nachgewiesen (Lemke 2008). Sie wird immer wieder in Waldhabitaten (Wälder, Waldränder) ausschließlich mit dem Klopfschirm erfasst. Der bisher letzte Nachweis gelang 2014 in Sereetz nördlich Lübecks. Die Art wurde sowohl auf Laub-, überwiegend jedoch auf Nadelzweigen nachgewiesen. Es ist davon auszugehen, dass es sich hier um eine mäßig häufige Art handelt, die fester Bestandteil der schleswig-holsteinischen Fauna ist. Sie wurde sehr wahrscheinlich aus nachweismethodischen und regionalen Gründen (Nachweise konzentrieren sich auf den südöstlichen Landesteil) früher übersehen.
Archaeodictyna consecuta (O. P. - Cambridge, 1872)
(Araneae, Dictynidae)
Im Mai 2008 gelang der Nachweis eines adulten Weibchens in einer ehemaligen Kiesgrube bei Breitenfelde (Lemke 2009). Diese Art wurde deutschlandweit zwischen 1970 und 2009 bisher nur für zehn Standorte dokumentiert (AraGes-Atlas 2017). Diese geringe Nachweisdichte lässt vermuten, dass es sich generell um eine sehr bis extrem seltene Art handelt. Sie ist nach der Roten Liste Deutschlands sehr selten und stark gefährdet (Blick et al. 2016).
Nach dem Erstfund gelang bislang kein weiterer Nachweis in Schleswig-Holstein. Auch eine Nachsuche am Ort des Erstfundes blieb erfolglos. In Mecklenburg-Vorpommern wurde sie Ende der 1970er Jahre in höheren Abundanzen auf Sandtrockenrasen nachgewiesen. Es handelt sich um eine thermophile Art, welche häufig auf freien Sandstellen umher läuft (Martin 1983). Beim Nachweis in Breitenfelde lief das Tier ebenfalls auf dem Boden umher, allerdings wurde keine große Anzahl an Tieren festgestellt.
Brigittea latens (Fabricius 1775),
Syn. Dictyna latens (Araneae, Dictynidae)
Der Erstnachweis für Schleswig-Holstein erfolgte 2005 in einem Wald bei Döhnsdorf (Hohwachter Bucht/Ostsee) (Lemke 2008). Neuere Nachweise weisen darauf hin, dass die Verbreitung dieser Art in Schleswig-Holstein auf den Bereich der Ostseeküste begrenzt ist: 3♂♂, 01.07.2012, Kiel Friedrichsort, 54,405805710,189681°, Düne, leg. & Coll. Wolff und 1♂ 28.06.2014, Strand westlich Großenbrode, 54,3823711,0822°, Düne, ZFMK-TIS 2534391.
Nach aktueller Nachweislage ergibt sich als Einstufung für eine Rote Liste der Häufigkeitsgrad ss (sehr selten), langfristiger Bestandstrend: unbekannt, kurzfristiger Bestandstrend: leicht steigend und auch bei Annahme einer grundsätzlichen Gefährdung von Küstendünen in Schleswig-Holstein eine Einstufung als ungefährdet, zumal diese Art in Schleswig-Holstein zwar hauptsächlich, aber nicht ausschließlich in Küstendünen der Ostsee nachgewiesen wurde.
Dipoena melanogaster (C. L. Koch, 1837)
(Araneae, Theridiidae)
Der Erstnachweis wurde in den Jahren 2004 bis 2008 erbracht (Lemke 2008). In den Jahren bis 2014 gelangen insgesamt fünf weitere Nachweise. 2010: Gudow und NSG Dummersdorfer Ufer 3♂♂ & 1♀, 2011: Negernbötel 1♀, 2014: Neumünster & NSG Pantener Moorweiher 1♀ & 2 juv. in unterschiedlichen Habitaten (Heide, Trockenrasen, aber meistens Waldstandorte). Schikora (2015) gibt als Habitatansprüche an: Relativ offene und besonnte Lebensräume. Dort meist auf Zweigen niedriger Sträucher, seltener am Boden. Der Autor konnte D. melanogaster per Klopfproben an Waldsäumen und am Rand kleiner Gehölzgruppen auf Zweigen nachweisen.
Diese Art ist damit im südöstlichen Landesteil weit verbreitet aber sehr selten. In der aktuellen Roten Liste (Lemke et al. 2013) ist sie bereits berücksichtigt und als ungefährdet eingestuft.
Dendryphantes rudis (Sundevall, 1833)
(Araneae, Salticidae)
Nach dem Erstnachweis 2007 in der Barker Heide (3 juv.) gelangen relativ regelmäßig weitere Nachweise, welche sich jedoch auf den südöstlichen Landesteil beschränken: 2010 Bröthen 1♀ & Gudow 1♂, 2013 Hornbek 1♂, 2015 Gronauer Heide 2♀. Die Art ist damit selten und relativ weit im südöstlichen Schleswig-Holstein verbreitet. Sie kommt in unterschiedlichen Habitaten vor (trockenes Grünland, Heide, Moor, Waldstandorte) und dort in den meisten Fällen auf Kiefernzweigen. Die Befunde bezeugen, dass D. rudis fester Bestandteil des Faunenspektrums Schleswig-Holsteins ist.
Der kurzfristige Bestandstrend ist aufgrund der vorhandenen Nachweise als konstant oder leicht steigend zu interpretieren und die Art deshalb als ungefährdet einzustufen.
Ero aphana (Walckenaer, 1802) (Araneae, Mimetidae)
Die Arten der Gattung Ero sind insgesamt an Nachweisen unterrepräsentiert, da bei Freilanduntersuchungen zwar relativ häufig Kokons zu entdecken sind, diese jedoch keiner konkreten Art, sondern nur der Gattung zugeordnet werden können.
Nach dem Erstnachweis von E. aphana am 28.06.2009 am Rand eines Trockenrasens im NSG Besenhorster Sandberge (1♂, 53°26,484/10°20,372 Potsdam) (Lemke 2009) gelangen zwei Nachweise an Hausfassaden. Am 19.10.2012 innerhalb der Lübecker Altstadt 1♀, 53,874317710,691633°, ZFMK-TIS 7090 und im Dorf Sarihusen (Kreis Steinburg) 1♀, 09.07.2016,54,0250709,7942°.
Funde von Ero aphana mit synanthropem Bezug werden bundesweit beobachtet. Da die Nachweise dieser Art in Schleswig-Holstein weit voneinander entfernt liegen, ist zu vermuten, dass sie auch in diesem Bundesland weit verbreitet und ungefährdet, aber nach derzeitiger Datenlage sehr selten ist. Für Schleswig-Holstein kann E. aphana nach aktueller Datenlage als ungefährdet eingestuft werden. In der Roten Liste (Lemke et al. 2013), welche nur auf einem Nachweis basierte, wurde E. aphana mit ”R„ eingestuft.
Evarcha laetabunda (C. L. Koch, 1846)
(Araneae, Salticidae)
Der Nachweis eines Männchens im Mai 2007 am Rand einer kleinen Heidefläche im Naturschutzgebiet Barker Heide (Lemke 2008) blieb lange Zeit der einzige für diese Art. Am 12.09.2015 gelang nach acht Jahren ein erneuter Nachweis auf einer sehr kleinräumigen dreieckigen Heidefläche von nur etwa 4400 qm am westlichen Rand des Segrahner Moors (1♀, N 53,550370 10,7899°, ZFMK-TIS 2559077).
Habitatanspüche von E. laetabunda in Mitteleuropa: Roberts (1995) nennt trockene Habitate, Martin (2014) Calluna-Heide und Bauchhenß (1990) listet E. laetabunda als in Mooren vorkommend und als typische Art für den den Xerotherm-Standort Typ ”B„: Unbestockte oder locker mit Kiefern/Wacholder bestandene Flächen mit geschlossener, mittelhoher Bodenbedeckung, deren bodennahe Strukturen ganzjährig persistieren (Zwergsträucher, borstige Strukturen, Nadelstreu). In Schleswig-Holstein wurde diese Art nur auf und am Rand von Sandheideflächen gefunden.
Heiden sind im südöstlichen Landesteil sehr seltene Habitate. Sie gehören in Schleswig-Holstein zu den am meisten gefährdeten Lebensräumen (Mordhorst & Brettschneider 2009). Dabei gehört die Barker Heide zu den ältesten Naturschutzgebieten des Landes: 1938 wurden 41 ha unter Schutz gestellt, 2003 wurde das Gebiet auf 682 ha erweitert.
In Norwegen wurde E. laetabunda erstmals am 15.8.2012 in einem Moor nachgewiesen (Farlund 2013, leg. Fjellberg), im Südosten des Landes, knapp 800 m von der Grenze zu Schweden entfernt. Die weite Verbreitung in ganz Europa spricht gegen eine klimatisch bedingte Ausbreitung. Nachweise fehlen im Norden nur für Großbritannien und Dänemark. Mit dem nunmehr zweiten Nachweis ist die Art weiterhin als extrem selten einzustufen und wie in der Roten Liste mit ”R„ einzustufen.
Lasaeola tristis (Hahn, 1833) (Araneae, Theridiidae)
Fünf Nachweise dieser kleinen schwarzen Kugelspinne wurden bisher für das ehemalige Übungsgebiet des Bundesgrenzschutzes und heutige Naturschutzgebiet Grönauer Heide im Süden Lübecks sowie für einen Trockenrasen bei Langenlehsten im südöstlichen Landesteil publiziert (Lemke 2008). Hinzu kommen neue Nachweise bei Schafhaus am Rand des Segeberger Forstes 2012 (sieben Jungtiere) und 2013 im Bereich des Büchener Sander und in Hornbek (je 1♂). Edaphische Gemeinsamkeit der Fundorte ist Sandboden.
Die Art ist in Schleswig-Holstein in lockeren Waldgesellschaften auf niedriger Vegetation und auf den unteren Zweigen von Bäumen und Gebüsch zu finden. Nachweismethoden: Streifkescher und Klopfschirm.
Für Schleswig-Holstein (Erstnachweis 2005) wird diese Art weiterhin als sehr selten und ungefährdet geführt (Lemke et al. 2013). Sie ist in ganz Skandinavien verbreitet. In Norwegen ist sie aber erst in vor neun Jahren aufgetaucht (Farlund 2015: Erstnachweis 2008), was die Frage nahelegt, ob das Auftreten von L. tristis klimatisch bedingt sein könnte.
Nigma walckenaeri (Roewer, 1951) (Araneae, Dictynidae)
Diese grüne Kräuselspinne ist aufgrund ihrer Färbung leicht zu bestimmen, aber zugleich leicht zu übersehen. Sie besiedelt typischerweise Fassadengrün, wo sie auf der Oberfläche leicht gewölbter Blätter ein kleines Netz aufspannt, unter dem sie sich verbirgt. Es liegt für Schleswig-Holstein mittlerweile eine Vielzahl an Fundmeldungen von unterschiedlichen Personen und Fundpunkten vor. Auf den Nachweiskarten spannt sich das bis dato bekannte Verbreitungsgebiet im Bundesland zwischen den Orten Wedel, Mölln und etwa dem Bungsberg (Hansühn) auf (AraGes-Atlas 2017). Möglicherweise ist N. walckenaeri noch weiter verbreitet. Man findet sie typischerweise nur durch Absuchen von Blattoberflächen.
Panamomops mengei Simon, 1926 (Araneae, Linyphiidae)
Der Erstnachweis für Schleswig-Holstein gelang am 19.05.2009 auf dem ehemaligen Truppenübungsplatzes Nordoe an der südlichen Stadtgrenze Itzehoes (1♀, 53°53,239/09°31,071 Potsdam) (Lemke 2009). Ein weiterer Nachweis dieser Art erfolgte auf demselben Gelände am 22.10.2012 (ZFMK-TIS 7096). Dieses 390 ha große Gelände wurde 2013 als Naturschutzgebiet ”Binnendünen Nordoe„ ausgewiesen.
Ein weiterer Nachweis von P. mengei gelang am 28.05.2015 im Kreis Rendsburg-Eckernförde südöstlich Owschlag in der Streu im Randbereich des kleinen Moores (1♂, 54°22,490/09°37,090, ZFMK-TIS 2551956). Am 27.09.2015 wurde im Hasenmoor (Kreis Segeberg) ein Nachweis an einem dritten Ort erbracht (2 ♀, 53°55,366/10°00,364). Damit sind nun drei relativ weit voneinander entfernt liegende Standorte für Schleswig-Holstein bekannt. Die Art ist in Deutschland hauptsächlich von den Mittelgebirgen bis nach Berlin verbreitet (AraGes-Atlas 2017). In Skandinavien tritt sie bis einschließlich Norwegen auf (Farlund 2015).
Bundesweit wird P. mengei als mäßig häufig und ungefährdet eingestuft (Blick et al. 2016). Nach nunmehr drei weit voneinander entfernten Nachweisen in Schleswig-Holstein ist sie hier als sehr selten und ebenfalls ungefährdet einzustufen. In der Roten Liste für Schleswig-Holstein ist sie noch als extrem selten und als ”R„ eingestuft (Lemke et al. 2013).
Parasteatoda simulans (Thoreil, 1875),
Syn.Achaearanea simulans (Araneae, Theridiidae)
Von dieser osteuropäisch verbreiteten Art (Martin 1974) liegt nach wie vor nur ein einziger Nachweis aus einem Wald bei Sande vor (1♂Juni 2005; Lemke 2008). Parasteatoda simulans ähnelt P. tepidariorum nicht nur im Aussehen, sondern auch in den Genitalstrukturen sehr, wird aber mit 2,7 bis 4,4 mm nicht ganz so groß wie P. tepidariorum, welche 3 bis 7 mm erreicht. Adulte Tiere lassen sich durch den Kulczynskischen Index, dem Quotienten aus der Länge der Tibia I und der Prosomalänge gegeneinander abgrenzen; P. simulans: 1,13— 1,27,P. tepidariorum: 1,42–1,48 (Martin 1974).Verwechslungen sind daher grundsätzlich möglich. Das Rote Liste-Schema von Ludwig et al. (2009) gibt hier eine Einstufung ”R„ vor, welche aber von sicher abzugrenzenden Arten aus geht - der Autor tendiert aufgrund der signifikanten Verwechslungsmöglichkeit hier von abweichend zu einer Einstufung ”D„ (Daten definzitär), welche die Regeln des BfN aber nicht hergeben.
Es wird notwendig sein, gezielt mit dem Klopfschirm nach dieser Art zu suchen. Martin (1974) gibt als Habitate an: Lichte Bereiche in Laubwäldern und an Waldrändern; (hemi-) hygrophil-hemiombrobiont. Dort an Baumstämmen, Sträuchern oder niedrigen Zweigen (Schikora 2015).
Pardosa saltans Töpfer-Hoffinann 2000 (Araneidae, Lycosidae)
Pardosa saltans wurde im Jahr 2000 von der weit verbreiteten und sehr häufigen Art P. lugubris abgetrennt (Töpfer-Hofmann et al. 2000). Bisherige Nachweise von P. lugubris sind als sensu lato anzusehen. Da P. saltans mit bis dato 26 Nachweisen weit verbreitet ist, wird sie als ungefährdet eingestuft. Sie besiedelt in Schleswig-Holstein Laubwälder, Mischwälder und Fichtenforste.
Philodromus albidus (Kulczyński, 1911) und P. rufus Walckenaer, 1826 (Araneae, Philodromidae)
Die seltenere Schwesterart P. rufus Walckenaer, 1826 wurde in der ersten Roten Liste als ungefährdet eingestuft (Reinke et al. 1998). Der aktuellen Datenlage nach ist P. albidus tatsächlich häufiger als P. rufus. Beide Arten sind nach den Genitalien nicht immer einfach zu unterschieden; am besten unterscheidet man die Männchen anhand derTibialapophyse des Pedipalpus (Blick & Segers 1993). Beide Arten werden mit dem Klopfschirm auf den unteren Zweigen von Bäumen und auf Gebüsch nachgewiesen. P. albidus ist — genau wie der seltenere P. rufus — ohne Zweifel fester Bestandteil der Fauna Schleswig-Holsteins.
Philodromus rufus ist in der aktuellen Roten Liste Schleswig-Holsteins mit ”Daten defizitär„ (D) angegeben. Aktueller Stand der Nachweise seit 2004 (weil nur die Männchen sicher bestimmbar sind, wurden nur Fänge von Männchen erfasst): 1♂, 19.05.2010, Kuhbrookmoor (Lübecker Stadtgebiet), 53°52,620/10°44,460 Potsdam, SK, feuchter Wald; 1♂, 11.06.2011, Karkfeld (südlich Lübecks), 53°48,000/10°39,960, SK, trockenes Grünland; 1♂, 27.06.2012, Segrahn, 53°32,837/10°46,916 Potsdam, Waldrand, SK; 1♂, 28.05.2012, Beutz, 53°56,022/10°46,529 Potsdam, Waldrand, SK; 1♂, 03.05.2014, Kreisforst Farchau, 53°39,674/10°51,985, Waldrand, KS. In Anbetracht der Verbreitung dieser auch deutschlandweit selten nachgewiesenen Art (Blick et al. 2016) ergibt sich keine Gefährdung. Interessanterweise wird P. rufus in der Roten Liste Niedersachsens nicht aufgeführt (Finch 2004). Für Niedersachsen existieren nur Nachweise ab 2010 (AraGes-Atlas 2017).
Psilochorus simoni (Berland, 1911) (Araneae, Pholcidae)
Der Erstnachweis für Schleswig-Holstein erfolgte im September 2008 in einem Keller in Norderstedt (leg. Eta) (Lemke 2009). Ein weiterer Nachweis folgte am 16.10.2010 ebenfalls in einem Keller: Lübeck N/O 1♀, 53°52,192/10°41,645 im Wohnhaus des Autors, ein dritter Anfang Oktober 2014 in einem Keller in Kiel 1♀, N/O 54°23,418/10°10,800 (leg. Schneider-Bujak). Weitere Nachweise gelangen am 23.01.2015 im Rahmen der Besammlung der Gewächshäuser der Gärtnerei und im öffentlichen Teil des Botanischen Gartens der Christian Albrecht Universität in Kiel (1♀ & 2 juv, 54,348197710,115655°, leg. & Coll. Wolff).
Diese Art stammt ursprünglich aus dem subtropischen Amerika und wurde nach Europa eingeschleppt. Sie kommt hier ausschließlich synanthrop vor und wird selten nachgewiesen (Kostanjsek & Ramsak 2005). Für den Faunenraum Schleswig-Holsteins wird daher vermutet, dass sie weit verbreitet ist, aber aufgrund der speziellen Habitatpräferenz nur zufällig in Kellern gefunden wird. Innerhalb Deutschlands wird diese Art immer nur in geringen Individuenzahlen nachgewiesen (Blick et al. 2006).
Steatoda grossa (C. L. Koch, 1838) (Araneae, Theridiidae)
Bis Januar 2016 wurden sämtliche Nachweise dieser im Jahr 2006 erstmals für Schleswig-Holstein nachgewiesenen Kugelspinne in und an Gebäuden innerhalb der Altstadt Lübecks erbracht. Bis auf die Ausnahme zweier Männchen, welche an Außenmauern in anderen Teilen der Altstadt gefunden wurden, stammen alle Nachweise aus der Wohnung oder dem Keller des Hauses des Verfassers. Diese Art ist in der Wohnung so regelmäßig anzutreffen, dass nicht jeder Fund aufgenommen wird. Sie lebt hier vor allem im Bodenbereich, wo sie unter Möbeln und auf Höhe von Fußleisten Gespinste webt, ist aber auch, wenn es Versteckmöglichkeiten gibt, weiter oben an Wänden zu finden. Im Januar 2016 wurde von S. grossa in Tarp, Kreis Schleswig-Flensburg ein adultes Weibchen in einem Apartment gefunden (1♀) und zur Bestimmung an das Senckenbergmuseum in Frankfurt am Main geschickt, wo es genitalmorphologisch bestimmt (Jäger in litt.) wurde (54°39,730/09°24,642, leg. A. & T. Dappert, Coll. SMF 66108 - 115). Aufgrund der neuen Nachweislage ist diese Art nicht mehr als extrem selten und ”R„, sondern als ungefährdet zu betrachten.
Diskussion
Unter den hier genannten elf für Schleswig-Holstein neuen Arachnidenarten ist ein Weberknecht (Anelasmocephalus cambridgei). Für die Berechnung der Gesamtartenzahl an Webspinnen wurden der Artnachweis von Araniella inconspicua in der aktuellen Rote Liste bereits berücksichtigt (Lemke et al. 2013). Die Zahl der in der Roten Liste genannten Gesamtartenzahl des Bundeslandes erhöht sich damit von den in der Roten Liste genannten 563 (Lemke et al. 2013) um neun auf 572 Arten (Stand 16.12.2017).
In den zurückliegenden zwölf Jahren hat der Autor 26 Spinnenarten und eine Weberknechtart neu für Schleswig-Holstein nachgewiesen. Die Artenzahl der Spinnen in Schleswig-Holstein zeigt einen nahezu stetigen Zuwachs ohne erkennbar einsetzende Sättigung (Abb. 6). Die geringfügige Abflachung im Jahr 2016 kommt dadurch zustande, dass der Autor zum Ende des GBOL-Projektes (voraussichtlich Ende 2018) seine Aufsammlungen in anderen Bundesländern intensiviert und darum weniger in Schleswig-Holstein aktiv ist.
Bei einem Teil der Erstnachweise blieb es bis dato bei nur einem einzigen Fund. Die Hintergründe hierfür sind nicht monokausal. Unklar ist, ob diese Arten nur extrem selten im Bundesland Vorkommen (dafür sprächen Vorkommen in benachbarten Regionen) oder ob dem jeweiligen Nachweis keine stabile Population zugrunde liegt und die Art somit nicht wirklich in Schleswig-Holstein etabliert ist. Für eine stabile Population sprechen wiederholte Nachweise über einen längeren Zeitraum, welche jedoch auch bei etablierten sehr seltenen Arten fehlen können. Andererseits können innerhalb längerer Zeiträume immer wieder auch Einzeltiere ohne stabile Population auftreten. Bei Arten, für die nach einem Erstnachweis keine erneuten Nachweise gelingen, muss konstatiert werden, dass der Erkenntnisumfang mittel- bis langfristig nicht ausreicht, die Frage der dauerhaften Zugehörigkeit zur Fauna des Landes sicher zu bewerten. Eine Gefährdungseinstufung als ”D„ (Datenlage defizitär) erscheint dem Autor in solchen Zweifelsfällen geboten. Allerdings sieht das Klassifizierungsschema des BfN in keiner Konstellation die Möglichkeit vor, eine extrem selten nachgewiesene Art mit ”D„ einzustufen. Wenn kein kurzfristiger oder lang fristiger negativer Bestandstrend angegeben werden kann, ist ausschließlich die Einstufung ”R„ möglich.
Allerdings steht und fällt so eine Einstufung mit der Ausgewogenheit an Nachweismethoden. Die Rote Liste der Spinnen Schleswig-Holsteins von 1998 hatte mit ihrem deutlichen Schwerpunkt auf Nachweisen aus Bodenfallen ein gewisses Defizit, weil höhere Straten unterrepräsentiert waren (Reinke et al. 1998). Ebenso war bis dahin der südöstliche Teil des Bundeslandes wenig untersucht. Viele wärmeliebende Arten haben aber im südöstlichen Landesteil die Grenze ihrer nacheiszeitlichen Nordausbreitung erreicht (Heydemann 1997). Dieser Teil Schleswig-Holsteins wird durch den Autor seit über 10 Jahren verstärkt untersucht. Eine intensive landesweite stratenübergreifende Untersuchung konnte aber trotzdem bis heute nicht erreicht werden. In vielen Bereichen Schleswig-Holsteins liegen intensivere Untersuchungen mehr als 30 Jahre zurück. Als besonders schlecht untersucht muss das küstenferne Landesinnere betrachtet werden. Hinzu kommt die oben angesprochene Faunendynamik, welche es praktisch unmöglich macht, das Faunenspektrum faktisch zu definieren. Der Kenntnisstand ist für verschiedene Regionen des Landes unvollständig während gleichzeitig das tatsächliche Artenspektrum ständigen Änderungen unterliegt. Die Anzahl 572 bekannter Arten kann daher nur als grober Näherungswert betrachtet werden.
Immer wieder wird die Frage aufgeworfen, ob die Arealausbreitung der Arten mit dem Klimawandel Zusammenhänge. Die Ausbreitungsmechanismen insbesondere der Spinnen und damit auch das Artenspektrum des Landes sind viel zu dynamisch, um zu dieser Fragestellung eine sichere Aussage machen zu können. Allerdings wird die Verbreitung nicht heimischer Arten durch den Klimawandel gefördert (Nentwig 2010) und kann daher nicht vollkommen losgelöst von diesem betrachtet werden. Mit dem Nachweis der wärmeliebenden Art Clubiona leucaspis ist nun erstmals eine klimatisch bedingte Ausbreitung festgestellt worden. Dies ist auch bei anderen Arten zu vermuten, aber bislang nicht zu belegen.
Die Hälfte der neuen Nachweise stammt aus Heiden; ebenso der Weberknecht Lacinus horridus. Heiden sind in Schleswig-Holstein in besonderem Maße gefährdet. Von einst 17 % heidebedeckter Landesfläche sind heute nur noch 0,2 % übrig (Raabe 1978, Freier 1979, beide zitiert in Voigt 1994). Die noch bestehenden Binnenheiden sind vor allem durch Selbstaussaat von Birken und Kiefern bedroht, da durch den Wegfall anthropogener Nutzung (Plaggenhieb und Beweidung) eine Sukzession zur Bewaldung einsetzt. Erhöhter Eintrag von Nährstoffen aus umliegenden landwirtschaftlichen Nutzflächen begünstigen die Vergrasung der Flächen (Heydemann 1997).
Danksagung
Vielen Dank an Andreas Schneider-Bujak (Kiel) für die Fundmeldung und Einsendung von Psilochorus simoni an den Autor. Ebenfalls danke ich Jonas O. Wolff (früher Kiel,jetzt Sydney/Australien) für die wertvollen Fundmeldungen und für die Organisation der Exkursion in den Botanischen Garten der Christian-Albrechts-Universität in Kiel. Ich danke ebenso Reinhard Degener (BUND-Ortsgruppe, Lübeck), Björn Rulik (ZFMK, Bonn), Jorgen Lissner (Naturhistorisches Museum, Aarhus/Dänemark) und Peter Jäger (Senckenberg Museum, Frankfurt/Main) für die informelle Unterstützung. Weiterer Dank gebührt Arno Grabolle für die Bereitstellung des Fotos des Weberknechtes Lacinius horridus. Ebenso danke ich Theo Blick und Tobias Bauer für die kritische Durchsicht in einer frühen Phase des Manuskriptes und hilfreiche Anmerkungen. Karl-Hinrich Kielhorn und nochmals Theo Blick danke ich für die Unterstützung bei der Literaturbeschaffung. Ein dritter Dank geht nochmals an Theo Blick für sein unermüdliches Bemühen, als Schriftleiter dem Manuskript den letzten Schliff zu geben. Ich danke auch Elisabeth Bauchhenß und Oliver David Finch für hilfreich kritische Hinweise als Gutachter.