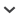Relatos de predação de primatas são escassos na literatura primatológica em decorrência, principalmente, das dificuldades de registrar eventos rápidos e raros (Urbani, 2005) e por que muitas observações ocorrem durante estudos com enfoque nos predadores ao invés das presas (Ferrari, 2009). Dentre os animais que consomem primatas podemos destacar os rapinantes, carnívoros de médio e grande porte, outros primatas e répteis (Ford e Boinski, 2007; Ferrari, 2009; Bianchi et al., 2010; Quintino e Bicca-Marques, 2013). A predação de primatas por felinos selvagens tem sido amplamente reportada (Calleia et al., 2009). Leopardus pardalis Linnaeus, 1758 é o felino que apresenta o maior número de estudos relacionado à sua dieta, embora dados oriundos de populações da Mata Atlântica brasileira sejam escassos (Bianchi et al., 2010). Estudos têm sugerido uma relação entre o tamanho do corpo da presa e o do predador (Calleia et al., 2009). Para L. pardalis tem sido reportado principalmente o consumo de pequenos mamíferos (até 2 kg), cuja frequência varia em resposta à abundância local das presas (Bisbal, 1986; Emmons, 1987). Contudo, este felino pode se alimentar esporadicamente de presas de maior porte (Konecny, 1989; Meza et al., 2002), como os bugios (Alouatta sp.) (Peetz et al., 1992; Miranda et al., 2006; Bianchi et al., 2010), seja via predação ou necrofagia (Crawshaw, 1995; Meza et al., 2002).
O presente estudo reporta o consumo de A. guariba clamitans por L. pardalis na Área de Relevante Interesse Ecológico (ARIE) Floresta da Cicuta (ca. 131 ha, 22°24′-22°38′S, 44°09′- 44°20′O, 300 - 500 m a.n.m.m.; Monsores et al., 1982), uma Unidade de Conservação de Uso Sustentável localizada nos municípios de Barra Mansa e Volta Redonda, Estado do Rio de Janeiro, Brasil. A região possui clima mesotérmico (Cwa), com inverno seco e verão quente e chuvoso, com elevados índices de umidade relativa do ar (Monsores et al., 1982). A ARIE está inserida na Floresta Estacional Semidecidual Submontana (IBGE, 1992) e é circundada por matas em estágio inicial ou médio de sucessão, antigos plantios de Eucalyptus spp. e pastagens (Alves e Zaú, 2005). A ARIE é habitada por cerca de 26 grupos de bugios-ruivos e uma população estimada em cerca de 150 indivíduos, sendo considerada uma das últimas populações do Vale do Paraíba do Estado do Rio de Janeiro (Alves e Zaú, 2005).
No dia 12/12/2012 foram encontradas fezes frescas de carnívoro (Fig. 1) em uma trilha permanente da ARIE. As fezes foram coletadas, acondicionadas em saco plástico e triadas para a realização de microscopia dos pelos-guarda em laboratório seguindo o protocolo de Quadros et al. (2006). Foram identificados pelos dos mamíferos Leopardus pardalis, Alouatta guariba clamitans e Akodon cursor Winge, 1887 (Fig. 2) com base em chaves dicotômicas de pelos (Ingberman e Monteiro-Filho, 2006; Vanstreels et al., 2010; Silveira et al., 2013).
Figura 1.
Amostra fecal de Leopardus pardalis encontrada em dezembro de 2012 na Área de Relevante Interesse Ecológico Floresta da Cicuta.

Figura 2.
Imagens de pelos de Alouatta guariba clamitans e Leopardus pardalis encontrados nas fezes de L. pardalis vistas em microscópio óptico comum. (A) Medula do pelo de A. guariba clamitans [células da medula unisseriadas isoladas e semi-escalariformes — Ingberman e Monteiro-Filho, 2006]. (B) Medula do pelo de L. pardalis [células da medula em formato trabecular com margens fimbriadas e largura medular com mais de 2/3 da largura do pelo — Vanstreels et al., 2010].

Bianchi e Mendes (2007) reportam uma grande importância de A. guariba clamitans na dieta de L. pardalis na Estação Biológica de Caratinga (EBC; atualmente, Reserva Particular do Patrimônio Natural Feliciano Miguel Abdala) no Estado de Minas Gerais, Brasil. Segundo Bianchi et al. (2010), a elevada taxa de predação de bugios na EBC pode estar relacionada à sua alta densidade. A grande abundância em florestas alteradas pelo homem é uma característica populacional conhecida de Alouatta spp. (Ferrari, 2009), cenário este compatível com o encontrado na EBC por Bianchi e Mendes (2007) e na área do presente estudo. Crawshaw (1995) e Meza et al. (2002) reportaram o consumo de carniça por jaguatiricas por considerarem que espécies de mamíferos de maior porte são consumidas apenas ocasionalmente (e. g., quando atropeladas). A distinção entre predação e necrofagia tem sido realizada com base na presença/ausência de larvas e pupas de moscas nas amostras fecais. Sua presença tem sido relacionada ao fato de as moscas poderem ovipositar poucos minutos após a morte do animal, embora a colonização das larvas dependa das condições climáticas (Smith, 1986). A confiabilidade desta evidência, no entanto, é comprometida quando o predador consome a carcaça logo após a morte do indivíduo e quando as fezes do predador contêm larvas e pupas de dípteros coprófagos (e.g., McAlpine et al., 1987; Francesconi e Lupi, 2012). A amostra fecal analisada no presente estudo estava fresca e continha muco, além de sinais de urina nas suas imediações (Fig. 1). Á semelhança do registrado por Miranda et al. (2006), não foram observadas larvas ou pupas de moscas.
O consumo de A. guariba clamitans do presente relato pode estar relacionado a uma combinação de quatro fatores: (i) pequeno tamanho e (ii) isolamento da Unidade de Conservação, (iii) alta densidade de A. guariba clamitans e (iv) plasticidade alimentar de L. pardalis. Os dados disponíveis, no entanto, não permitem descartar a hipótese de se tratar de um caso de predação oportunística (Miranda et al., 2006), cujo impacto na população de bugios-ruivos seria, provavelmente, insignificante. Por fim, o uso experimental de armadilhas fotográficas para monitorar o destino e os consumidores de carniça de primatas (e.g., Huang et al., 2014), aliado a análises dos pelos encontrados nas fezes de predadores, possui grande potencial para elucidar a relação entre os primatas e seus potenciais predadores.
Agradecimentos
Ao Felipe Sardella e ao José Henrique de Oliveira pela ajuda na logística do trabalho de campo. À Companhia Siderúrgica Nacional (CSN) pelo apoio na realização deste trabalho. Ao Centro Brasileiro para Conservação dos Felinos Neotropicais por disponibilizar amostras de pelos para comparação. Ayesha Ribeiro Pedrozo e Theany Biavatti agradecem à CAPES pela bolsa de Mestrado. William Douglas de Carvalho agradece à CAPES pela bolsa de Doutorado. Carlos E. L. Esbérard agradece ao CNPq pela bolsa de Produtividade em Pesquisa e à FAPERJ pela bolsa de Jovem Cientista do Nosso Estado. Ao editor Júlio César Bicca-Marques pelas sugestões no texto. Este trabalho foi realizado sob a licença especial para coleta SISBIO 10356-2.