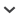Jeanmonod, D. & Y. Naciri (2021). A taxonomic revision of Ranunculus sect. Batrachium in Corsica: a morphological and statistical analysis. Candollea 76: 275–292. In French, English and French abstracts.
In Corsica, the species of Ranunculus sect. Batrachium DC. are poorly defined due to a lack of sufficient observations and because the group is taxonomically complex. Our study concerns 113 individuals collected around the whole island, and is based on a biometric study of 16 morphological characters and field observations (plant development, intrapopulation variability, ecology). As a result, several species are excluded from the section and the groups Ranunculus peltatus aggr., Ranunculus penicillatus aggr., and Ranunculus trichophyllus Chaix are retained. These groups are statistically discriminated by fruiting pedicel length and multifidous leaf length. The species present on the island are Ranunculus penicillatus (Dumort.) Bab., Ranunculus saniculifolius Viv. (initially attributed to Ranunculus peltatus aggr.), and Ranunculus trichophyllus Chaix. An identification key to Corsican species is provided, as well as information concerning the ecology and distribution of each species.
First published online: October 13, 2021.
Introduction
Les renoncules aquatiques à fleurs blanches font partie de Ranunculus sect. Batrachium DC. (Wiegleb et al., 2017) mais ont été souvent considérées comme un sous-genre (Ranunculus subgen. Batrachium (DC.) Ser. (Cook, 1966; Lansdown, 2007; Gonard, 2010; Desfayes, 2016; Pignatti, 2017). Ce groupe a été plus rarement considéré comme un genre distinct (Batrachium (DC.) Gray; Wang et al., 2009). Il se caractérise par des fruits présentant des crêtes transversales formées de cellules sclérifiées (Cook, 1963), mais aussi par la présence de fleurs blanches (à l'exception de Ranunculus flavidus (Hand.-Mazz.) C.D.K. Cook) et de feuilles multifides (sauf chez R. hederaceus L. et R. omiophyllus Ten.) accompagnées ou non par des feuilles laminaires. A l'intérieur du genre Ranunculus L. (Ranunculaceae), ce groupe forme un clade distinct au sein des groupes de renoncules non aquatiques (Hörandl et al., 2005; Emadzade et al., 2010; Hörandl & Emadzade, 2012; Hörandl, 2014).
Ranunculus sect. Batrachium se révèle être particulièrement difficile du fait d'un degré de plasticité phénotypique extrême (Cook, 1966; Dahlgren, 1995; Pizarro, 1995). S'ajoute à cela la présence d'hybridations fréquentes entre espèces (Cook, 1966; Wiegleb et al., 2017). Certaines espèces reconnues, comme R. aquatilis L., R. penicillatus (Dumort.) Bat. et R. pseudofluitans (Syme) Baker & Foggitt seraient même d'origine hybride (Cook, 1966; Lansdown, 2007; Wiegleb et al., 2017).
La section Batrachium a fait l'objet d'importantes monographies au niveau mondial (Hiern, 1871; Glück, 1924; Cook, 1966; Wiegleb et al., 2017) et au niveau méditerranéen dans la péninsule Ibérique (Cook, 1986). Wiegleb et al. (2017) reconnaissent 30 espèces au niveau mondial. Les divers traitements de régions proches de la Corse, comme la France métropolitaine (Gonard, 2010; Mouronval & Baudoin, 2010; Tison & Foucaud, 2014) et sa zone méditerranéenne (Tison et al., 2014), l'Italie (Pignatti, 1982, 2017; Conti et al., 2005), la péninsule Ibérique et les îles Baléares (Bolòs & Vigo, 1984; Cook, 1986; Cirujano et al., 2014), ou encore la Sardaigne (Arrigoni, 2006), ont conclu à des concepts taxonomiques parfois bien différents, notamment concernant R. peltatus Schrank (Velayos, 1988; Pizarro, 1995) et R. penicillatus, tous deux signalés en Corse.
Les traitements successifs pour la Corse de Briquet (1910), Pignatti (1982), Gonard (2010) et Jeanmonod & Gamisans (2013) ont montré de fortes disparités quant au nombre de taxons et à leur attribution, ceci aussi en comparaison avec la Sardaigne (Arrigoni, 2006) (tableau 1). Ces différentes visions taxonomiques proviennent de la plasticité phénotypique de ces taxons en relation notamment avec les conditions écologiques. Un traitement taxonomique satisfaisant en Corse ne peut être réalisé qu'avec le support d'une analyse de la plasticité phénotypique des populations et des facteurs l'influençant.
Nous avons donc entrepris des analyses morphologiques et statistiques de cette section sur la base de 16 caractères morphologiques provenant de 113 individus récoltés sur l'ensemble de l'île. Ces analyses ont été complétées par des observations de terrain relevant du développement des plantes, de leur variabilité intrapopulationnelle et de leur écologie. Cette approche nous a permis d'identifier les différents taxons à inclure au sein de Ranunculus sect. Batrachium pour la Corse.
Variabilité phénotypique
Les renoncules aquatiques se divisent morphologiquement en trois grandes catégories: (a) un groupe présentant des feuilles multifides et submergées, qui sont des plantes entièrement aquatiques ou hydrophytes; (b) un groupe présentant des feuilles laminaires, qui sont des plantes essentiellement terrestres en bordure de zones humides ou amphiphytes; (c) un groupe incluant les taxons hétérophylles pouvant présenter les deux types de feuilles multifides et laminaires ou parfois avec uniquement des feuilles multifides, qui sont des plantes aquatiques ou en bordure de zones humides. Selon Wiegleb et al. (2017), cette hétérophyllie serait le résultat d'une évolution convergente. Les plantes hétérophylles ne présentent généralement des feuilles laminaires qu'au moment de la floraison et uniquement au niveau des pédicelles floraux. Les feuilles multifides peuvent également être aériennes, notamment lorsque le niveau d'eau est bas.
Les caractères utilisés pour distinguer les espèces entre elles sont principalement la forme et la taille des feuilles multifides et des feuilles laminaires, la soudure des stipules, la longueur des pédicelles fructifères, la taille des pétales et la forme de leur nectaire, la pilosité et la forme des réceptacles floraux, le nombre, la taille et la pilosité des akènes. Les rapports entre plusieurs de ces caractères sont aussi souvent utilisés (par exemple, longueur des feuilles ou des pédicelles vs. des entrenœuds ou des pétioles correspondants respectivement). La conjonction de plusieurs de ces caractères permet généralement de séparer globalement les espèces. Cependant, la réalité du terrain montre que la variabilité observée n'est pas la même selon les régions et que bien des individus restent difficiles à attribuer à l'une ou l'autre des espèces. La délimitation des espèces semble notamment fluctuer selon que l'on est en région tempérée ou en région méditerranéenne. Si les taxons de Ranunculus peltatus aggr. semblent par exemple être bien distincts dans les régions tempérées, cela n'est en revanche plus le cas dans les régions méditerranéennes (Velayos, 1988; Tison et al., 2014).
La compréhension du développement et de la morphologie des plantes en fonction des conditions environnementales au travers d'études expérimentales est donc une clé pour l'interprétation taxonomique (Dawson, 1980; Volder et al., 1997; Garbey et al., 2004, 2006; Piñero-Rodríguez et al., 2019).
Polyploïdie et génétique
Ranunculus sect. Batrachium est un complexe polyploïde comprenant des diploïdes, triploïdes, tétraploïdes, pentaploïdes et hexaploïdes avec un système combinant divers types de reproduction sexuée et de propagation végétative (Dahlgren, 1995). L'autofécondation comme la cleistogamie sont présents. Le groupe est caryologiquement assez homogène avec un nombre chromosomique de base de n = 8 (Baltisberger & Hörandl, 2016). Prančl et al. (2018) trouvent trois cytotypes tétraploïdes pour R. trichophyllus en Autriche et Tchéquie, six pour R. penicillatus et 16 pour divers hybrides du groupe.
Des analyses moléculaires ont été menées au sein de cette section, cependant uniquement sur la base d'un faible nombre de récoltes, probablement mal déterminées (Wiegleb, pers. comm.) et issues de territoires restreints, presque uniquement situés en Europe tempérée (Hörandl et al., 2005; Lansdown, 2007; Emadzade et al., 2011; Telford et al., 2011; Lumbreras et al., 2014; Zalewska-Gałosz et al., 2014). Ces études montrent globalement que les taxons hétérophylles proches (Ranunculus aquatilis, R. baudotii Gord., R. peltatus, R. penicillatus et R. saniculifolius Viv.) ne peuvent pas être discriminés génétiquement à l'aide de marqueurs classiques. Zalewska-Gałosz et al. (2014) confirment en revanche l'origine hybride des populations étudiées de R. penicillatus.
La situation climatique en Méditerranée est différente de celle des régions tempérées. Elle est marquée par des variations saisonnières et annuelles beaucoup plus importantes et fréquentes (assèchement des mares, destruction de plantes lors de fortes inondations). Cela impacte fortement la dynamique des populations (baisse drastique ou disparition des populations, régénération par germination des graines du sol, nouvel apport par l'avifaune). La morphologie des plantes est aussi impactée et par conséquent leur attribution spécifique. Coppi et al. (2015) a notamment mis en évidence l'influence de la dérive génétique et des effets de fondation pour des populations végétales vivant dans des plans d'eau éphémères probablement colonisés via des akènes transportés par des oiseaux. Un impact conséquent aussi peut être mesuré sur la conservation de ces stations (Coppi et al., 2015; UICN, 2021).
Tableau 1.
Taxons de Ranunculus sect. Batrachium DC. signalés en Corse par Briquet (1910), Pignatti (1982), Gonard (2010) et Jeanmonod & Gamisans (2013) comparés avec ceux de Sardaigne selon Arrigoni (2006).

Ranunculus sect. Batrachium en Corse
En faisant la synthèse de tous les taxons cités en Corse et de tous ceux mentionnés dans la littérature récente dans les régions avoisinantes, 14 taxons sont susceptibles d'être présents en Corse. Il s'agit de Ranunculus aquatilis, R. baudotii, R. circinatus Sibth., R. fluitans Lam., R. hederaceus, R. ololeucos J. Lloyd, R. omiophyllus, R. peltatus, R. penicillatus, R. pseudofluitans, R. saniculifolius, R. trichophyllus Chaix, R. tripartitus DC. et R. vertumnus (C.D.K. Cook) Luferov. Dans cet article, nous nous réfèrerons aux données (concepts, clés et descriptions générales) de Wiegleb et al. (2017).
Parmi ces taxons, cinq n'ont jamais été signalés en Corse. On recense ainsi Ranunculus circinatus (caractérisé par des feuilles multifides en cercle sur un seul plan, présent dans le sud de la France et en Italie), R. hederaceus (caractérisé par des feuilles uniquement laminaires, présent en France et dans la péninsule Ibérique), R. ololeucos (caractérisé par des pétales entièrement blancs, signalé en Espagne), R. omiophyllus (taxon homophylle à feuilles laminaires; péninsule Ibérique, France et sud de l'Italie), et enfin R. tripartitus (caractérisé par des pétales petits (1–5 mm), des pétioles faiblement adnés sur la moitié du pétiole et des feuilles laminaires aux lobes profondément disséqués, signalé en Sardaigne mais à répartition principalement atlantique); voir tableau 1.
Parmi les taxons signalés en Corse, Ranunculus aquatilis et R. fluitans ont subi un changement de concept taxonomique et doivent donc être réévalués. Desfayes (2008, 2011, 2016) exclut par exemple R. aquatilis d'Italie, de Sardaigne et de tout le sud des Alpes alors que Dahlgren & Jonsell (2001) le synonymise avec R. trichophyllus en Scandinavie. Ranunculus peltatus, R. baudotii et R. saniculifolius font partie de l'agrégat de R. peltatus. Ils sont considérés soit comme des sous-espèces (Velayos, 1984; Valdés, 1987; Lambinon et al., 1989; Conti et al., 2005; Gonard, 2010; Cirujano et al., 2014; Tison & Foucault, 2014; APD, 2020), soit comme espèces (Wiegleb et al., 2017). Pour ces derniers, le choix d'un rang sous-spécifique introduirait un taxon polyphylétique.
Ranunculus penicillatus, R. pseudofluitans et R. vertumnus font partie de R. penicillatus aggr. et leur fort polymorphisme a conduit à divers traitements et concepts (Zalewska-GaŁosz, 2014). Wiegleb et al. (2017) acceptent ces trois taxons au rang spécifique pour les mêmes raisons que R. peltatus aggr. Zalewska-GaŁosz (2014) a montré l'origine hybride de populations polonaises de R. penicillatus (R. fluitans × R. peltatus) si bien que Wiegleb et al. (2017) considèrent que ce taxon hétérophylle doit être restreint à l'espèce issue de cette hybridation. Ce taxon étant fertile, son aire de répartition peut dépasser celles des parents putatifs. Ranunculus pseudofluitans devrait, quant à lui, être réduit au taxon homophylle allopolyploïde, stérile, issu du croisement entre R. fluitans et R. circinnatus selon Wiegleb et al. (2017).
Ranunculus trichophyllus fait partie lui d'un autre groupe que les deux aggrégats précédents (Wiegleb et al.,2017).Il ne pose pas de problème taxonomique particulier.Toutefois,selon Wiegleb et al.(2017) et Jopek & Zalewska-GaŁosz (2020), cette espèce est génétiquement hétérogène avec des nombres chromosomiques variables.Elle présente plusieurs lignées avec des populations géographiquement et écologiquement diversifiées ou des espèces cryptiques.
Matériel et méthodes
Spécimens d'herbier consultés
L'ensemble des spécimens d'herbier de Genève (G et G-BU, dont notamment toutes les récoltes en Corse faites par Briquet, Litardière, Gamisans et Deschâtres), ainsi que de nombreux doubles de Lambinon (voir Jeanmonod, 2017) et un spécimen issu de l'herbier privé de Tison (Tison s.n. [1.V.1982]) ont été analysés. Ce matériel représente 113 individus étudiés provenant de 112 récoltes ou spécimens d'her-bier distincts. En effet, les récoltes en herbier étaient pour la plupart composées d'un seul individu, parfois de plusieurs individus homogènes dont un seul a été choisi, à l'exception d'une récolte (Thiébaud T02243). Nous avons confronté ces données avec celles des régions avoisinantes (France continentale, Sardaigne, Italie continentale, Baléares et péninsule Ibérique) et avec toutes les données de littérature connues pour la Corse (Bertoloni, 1833–1857; Salis-Marschlins, 1834; Marsilly de Commines, 1872; Boullu, 1878; Gillot, 1878; Petit, 1885; Foucaud & Simon, 1898; Rouy & Camus, 1900; Lutz, 1903; Maire, 1904; Litardière, 1909; Briquet, 1910; Litardière, 1953; Jeanmonod et al., 1986; Lambinon et al., 1989; Jeanmonod & Burdet, 1989, 1999; Lambinon, 2000; Jeanmonod & Schlüssel 2012).
Observations de terrain
Tous les types de milieux aquatiques de Corse ont été explorés, du littoral jusqu'en haute montagne. Pour ceux où des renoncules aquatiques étaient recensées dans le cadre d'observations menées entre 1985 et 1988, ainsi qu'en 2019, la profondeur de l'eau, la vitesse du courant et la transparence de l'eau ont été mesurées. Trois grands types de milieux ont été distingués: (a) les eaux profondes (> 50 cm) et courantes, c'est-à-dire rivières, milieux généralement oligotrophes; (b) les eaux peu profondes (< 50 cm) et peu courantes, c'est-à-dire ruisseaux, fossés, petites rivières, milieux oligo- à mésotrophes; (c) les eaux stagnantes à profondeur variable, c'est-à-dire mares, étangs, trous d'eau, milieux eutrophes.
Analyse morphologique
Seize (16) caractères morphologiques habituellement ou occasionnellement considérés pour le diagnostic dans les monographies et les clés de détermination ont été mesurés et analysés pour les 113 individus étudiés. Il s'agit de: (1) présence ou non de feuilles laminaires; (2) longueur de la plus grande feuille multifide; (3) type de feuille multifide (flasque, ± flasque, ferme); (4) rapport entre les feuilles multifides et l'entrenœud correspondant (>, < ou ± égal); (5) longueur du plus long pédicelle fructifère; (6) longueur de l' entrenœud correspondant au pédicelle mesuré; (7) diamètre de la tige; (8) rapport entre la longueur du pédicelle fructifère et le pétiole de la feuille laminaire supérieure correspondante; (9) soudure des stipules au pétiole (< 0,5 / 0,5–0,75 / > 0,75 de la longueur du pétiole); (10) longueur maximale des pétales; (11) type de nectaire sur les pétales (circulaire, lunulaire, pyriforme); (12) pilosité du réceptacle (poilu, glabre); (13) forme du réceptacle (sphérique, allongé); (14) nombre d'akènes; (15) longueur maximale des akènes; (16) pilosité des akènes. D'autres caractères ont été mesurés ponctuellement comme la taille des sépales et celle de l'infrutescence.
Analyse statistique
Sur ces 16 caractères, 10 ont été utilisés dans l'analyse statistique pour leur facilité de mesure et la possibilité de les répéter sur un autre matériel (voir tableau 2). Pour tous ces caractères, les moyennes et variances ont été calculées par taxon grâce au programme R (R Core Team, 2013)
Sur les 113 échantillons d'herbier compilés, 87 individus ont servi aux analyses statistiques. Les autres individus ont été écartés, soit parce qu'il s'agissait de formes terrestres, soit parce qu'ils étaient incomplets sur le plan morphologique (par exemple absence de fruits ou de pétales, etc.). Sur ces 87 individus, 77 ont servi de matériel pour l'analyse car ils pouvaient facilement être attribués à une espèce. Les 10 restants ont servi d'«individus-test». Ces «individus-test» étaient en effet difficiles à déterminer avec certitude et nous avons estimé qu'il pouvait s'agir d'hybrides, pour certains d'entre eux du moins.
Une représentation des médianes, premiers et troisièmes quartiles, ainsi que des valeurs extrêmes a été obtenue pour chaque taxon et chaque caractère à l'aide de la commande «boxplot» dans R. Pour chaque caractère, l'homoscédasticité des variances entre taxons a été vérifiée grâce au test de Bartlett [bartlett.test], de même que la normalité des distributions intra-taxon a été évaluée à l'aide du test de Shapiro [shapiro. test]. Comme la plupart des caractères ne remplissaient pas les conditions d'application des tests paramétriques, le test non paramétrique de Kruskal-Wallis [kruskal.test] a été retenu pour comparer les moyennes entre taxons.
Une analyse linéaire discriminante a ensuite été menée sur l'ensemble des individus (77) à l'aide de la commande «lda» du package Mass (Venables & Ripley, 2002) pour obtenir la fonction discriminante et une classification des individus a posteriori. Cette dernière a été extraite de la table de confusion obtenue à l'aide de la commande «predict». La commande «stepclass» du package klaR (Weihs et al., 2005) a été utilisée pour trouver les caractères discriminant le mieux les taxons. Sur la base de ces analyses, les «individus-test» (10) ont été à leur tour classés. Les graphiques ont été obtenus à l'aide de la commande «s.class» du package ade4 (Dray & Dufour, 2007). Les fichiers de données et les programmes utilisés sont accessibles via la plateforme Github [ https://github.com/YNaciri-cjbg/Ranunculus].
Résultats et discussion
Observations de terrain
Nos observations (menées de 1985 à 1988 et en 2019) montrent que les renoncules aquatiques se rencontrent dans la plupart des types de milieux aquatiques à des fréquences très variables. Les eaux courantes plus ou moins profondes (fleuves, rivières, canaux et ruisseaux) ne renferment que rarement des plantes à feuilles laminaires au sein de populations très localisées. Les eaux calmes, généralement peu profondes et à niveaux fluctuants (lacs, mares, gouilles, marais) sont plus fréquemment colonisées par des populations à feuilles laminaires. Les eaux eutrophes (mares, canaux, etc.) abritent plus fréquemment des renoncules aquatiques que les eaux oligo- à mésotrophes (fleuves et rivières). Si les plantes sont nettement plus fréquentes à basse altitude (y compris sur le littoral), elles peuvent néanmoins croître à une altitude d'au moins 1200 m. Les courants forts en amont de la plaine de la plupart des fleuves et des rivières et l'épais ombrage de la ripisylve ne permettent pas leur établissement. Il faut relever que la Corse a été marquée ces dernières années par des phénomènes climatologiques extrêmes avec d'importantes inondations qui arrachent les pieds des végétaux et les rejettent à la mer. De nombreuses populations en eaux courantes et en eaux calmes ont ainsi disparu (A. Delage, pers. comm.; obs. pers.).
Tableau 2.
Liste des 10 caractères retenus pour les analyses statistiques avec leur code. Les valeurs maximales ont été prises en compte. [Abréviations: D = diamètre; Flle = feuille; L = longueur; Nbre = nombre)

Développement, influence du milieu et écologie
Les observations de Garbey et al. (2004) sur Ranunculus peltatus en Moselle (NE France) témoignent de deux grands stades de développement. Un premier stade d'extension en longueur a lieu avec le développement des entrenœuds d'avril à mai, suivi d'un second stade d'expansion latérale simultané à la floraison et avec un maximum en juin. La sénescence des feuilles multifides commence en mai et la plante décline en août. Les rameaux deviennent alors fragiles et se cassent en permettant une dispersion végétative (Dawson, 1980). Nos observations confirment ce développement avec un décalage chronologique d'environ 1 mois (début en mars). Elles permettent aussi de confirmer que la floraison en Corse pour les espèces hétérophylles se déclenche approximativement lorsque la plante atteint la surface de l'eau, ceci avant le développement de feuilles laminaires. Cette phase temporaire homophylle peut conduire à de mauvaises identifications. Par ailleurs, l'absence d'eau en suffisance permet la floraison mais empêche le développement de feuilles laminaires et modifie en conséquence le développement de feuilles multifides. Celles-ci (formes dites «terrestres») deviennent alors courtes, fermes et rigides indépendamment de l'espèce. La longueur des entrenœuds est également raccourcie en raison de l'insuffisance en eau.
Analyse morphologique
L'examen de tous les spécimens d'herbiers de Corse et des données de la littérature insulaire permet d'établir que tous les individus présentent des feuilles multifides. Ils ont aussi des stipules adnés sur 66 à 90 % du pétiole, des sépales petits (2–5 mm de long) teintés de bleu sur la marge et l'apex, des fleurs blanches à onglet jaune et des réceptacles sphériques et poilus. Les feuilles multifides ont une taille très variable (2–13 cm de long) et sont plus ou moins rigides en se mettant ou non en pinceau lorsque sorties de l'eau. Les feuilles laminaires sont présentes sur 56,6 % des individus en eau courante ou stagnante, les feuilles intermédiaires n'apparaissant que dans le tiers des cas. Les pétales ont une amplitude de taille relativement peu marquée (4–12 mm de long) avec des nectaires lunulaires ou pyriformes se rapprochant rarement d'une forme circulaire. Les carpelles sont présents en nombre (11–68) et en taille (1–2 mm de long) variables sans groupes précis. Ils sont glabres à 90 %.
L'analyse morphologique montre que les individus corses se répartissent en trois grandes catégories: (1) un groupe hétérophylle à petites feuilles multifides étalées (2–5 cm de long; fig. 1A–B); (2) un groupe homophylle ou hétérophylle à grandes feuilles multifides flasques (6–13 cm de long; fig. 1C–D); (3) un groupe homophylle à petites feuilles multifides étalées (2–6 cm de long; fig. 1E–F). Elle permet d'écarter la présence en Corse de cinq espèces dont la morphologie caractéristique n'a pas été observée. Il s'agit de Ranunculus hederaceus et R. omiophyllus (homophylle à feuilles laminaires), R. ololeucos à pétales entièrement blancs, R. circinatus à feuilles rigides étalées caractéristiques et enfin R. tripartitus à feuilles très divisées et fleurs très petites à pétales bien séparés.
Ranunculus fluitans est également absent car aucun individu ne possède de réceptacle glabre, de feuilles multifides très grandes (10–20 cm de long) et peu divisées (< 30 segments) selon le concept de Englmaier (2016) et Wiegleb et al. (2017). Les individus homophylles à feuilles modérément grandes (6–13 cm de long) et très divisées sont donc rattachées à R. penicillatus aggr.
L'absence d'individus à nectaires nettement circulaires met fortement en doute la présence de Ranunculus aquatilis en Corse. Le concept taxonomique de ce taxon rend sa distinction difficile avec d'autres taxons hétérophylles comme R. peltatus aggr., R. tripartitus, voire même R. trichophyllus puisque les feuilles laminaires peuvent manquer chez certaines formes de R. aquatilis (Wiegleb et al., 2017). Cette dernière espèce possède des pédicelles relativement petits (15–45 mm de long) et plus courts que le pétiole correspondant (Cook, 1966) ou que l'entrenœud correspondant (Tison et al., 2014), des pétales petits (3–5 mm de long) (Cook, 1986), ainsi que des feuilles laminaires à marges dentées. Ces caractères ne sont pas tous reconnus par Wiegleb et al. (2017). Notre analyse montre que si de rares individus corses présentent l'un ou l'autre des caractères mentionnés ci-dessus, aucun d'entre eux ne présente un ensemble suffisant de caractères spécifiques propres à cette espèce. Ils ne présentent pas de caractères distincts à ceux de R. peltatus aggr. leur permettant d'être attribués avec certitude à R. aquatilis. Ce résultat corrobore Desfayes (2008, 2011, 2016) qui exclut R. aquatilis de tout le sud des Alpes.
Tableau 3.
Analyse discriminante sans validation croisée sur les 77 individus de base. [Abréviations: * = Mombrial FM01823; ** = Jeanmonod J2420, J8220]

L'analyse de l'ensemble des individus corses permet donc de restreindre la présence de Ranunculus sect. Batrachium à trois ensembles taxonomiques: (a) Ranunculus peltatus aggr. pour le groupe hétérophylle à petites feuilles se rencontrant dans les eaux calmes (mares, gouilles, marais, canaux); (b) Ranunculus penicillatus aggr. pour le groupe à grandes feuilles (homo- ou hétérophylle) présent dans les eaux courantes et profondes (rivières); (c) Ranunculus trichophyllus pour le groupe homophylle à petites feuilles vivant dans les eaux moyennement courantes et de faible profondeur. Toutefois certains individus sont difficiles à attribuer à l'un ou l'autre de ces taxons, leurs caractères se distribuant sur 2 ou 3 de ces taxons. Le développement des plantes en fonction de la période de récolte et du milieu influence également certains caractères, notamment végétatifs. L'intérêt d'analyses statistiques pour tester la valeur des caractères et l'attribution des individus atypiques («échantillons-test») est donc à relever.
Analyse statistique
Les trois groupes précédents ont été traités statistiquement pour les dix caractères quantitatifs sélectionnés (tableau 2).
Analyse sur le lot de base
L'analyse discriminante sur l'ensemble des 77 individus (fig. 2) montre que les 18 individus attribués initialement à Ranunculus penicillatus aggr. constituent un groupe bien séparé. Ils sont également tous confirmés comme appartenant à ce groupe (tableau 3). Ranunculus peltatus aggr. (43 individus) et R. trichophyllus (16 individus) sont moins bien séparés, mais le caractère discriminant (l'absence ou la présence de feuilles laminaires) entre ces deux taxons est un caractère qualitatif. Ce caractère n'a pas été utilisé ici. Seuls 3 individus (3,9 %) ont été significativement attribués au mauvais taxon (P < 0.05) (fig. 2; tableau 3).
Fig. 1.
Ranunculus sect. Batrachium DC. A–B. Ranunculus saniculifolius Viv.; C–D. Ranunculus penicillatus (Dumort.) Bab.; E–F. Ranunculus trichophyllus Chaix. [A–B: Jeanmonod J8212; C: Jeanmonod J8221; D: Jeanmonod J8224; E–F: Jeanmonod J8226] [Photos: D. Jeanmonod]

Fig. 2.
Analyse linéaire discriminante sur 77 individus. Les cercles contiennent 95 % de la variation pour chaque espèce et avec, entre parenthèses, les pourcentages statistiques d'attribution des trois individus faussement classifiés. La couleur des pourcentages se réfère à l'espèce considérée (vert: Ranunculus trichophyllus Chaix; orange: R. peltatus aggr.; bleu: R. penicillatus aggr.).

Le premier individu (Mombrial FM01823), attribué à Ranunculus trichophyllus, présente des feuilles laminaires pour-tant absentes chez ce taxon, ainsi que plusieurs caractéristiques de R. peltatus aggr. Les pétales mesurés sont courts (4 mm de long) car provenant de boutons floraux, ce qui expliquerait cette attribution statistique différente. Les deux autres individus (Jeanmonod J2420 et J8220), attribués à R. peltatus aggr., sont dénués de feuilles laminaires et ne peuvent donc être déterminés à ce taxon (les plantes n'étant pas dans leur jeune phase homophylle). Leur attribution est sans doute due à la grandeur des pédicelles et pétales. Ceux-ci sont en effet importants chez R. trichophyllus. Une hybridation est dès lors supposée.
Les deux caractères les plus influents permettant la séparation des trois groupes sont PED_LONG et FLL_MUL (tableau 2). Le premier permet de discriminer 75 % des individus et l'ajout du second augmente ce score à 87 %. Nul troisième caractère ne permet d'améliorer ce score de plus de 5 %.
Analyse restreinte
Une seconde analyse a été conduite sur un lot restreint d'individus de Ranunculus peltatus aggr. (43) et R. trichophyllus (16). Comme ces deux taxons se distinguent essentiellement par la présence ou non de feuilles laminaires, cette analyse a pour but de mettre en évidence les caractères diagnostiques s'exprimant avant le développement des feuilles laminaires chez R. peltatus. Elle fait ressortir que le caractère le plus influent permettant la séparation des deux groupes est RAP_P/E (tableau 2) à 87 %.
Dans cette seconde analyse, 3 individus ont été statistiquement attribués au mauvais taxon (5,1 % du total). Thiébaud & Jeanmonod T06932 a été attribué à 51 % à Ranunculus trichophyllus au lieu de R. peltatus aggr. et Jeanmonod J8220 (51 %) et J2420 à (64 %) ont été attribués à R. peltatus aggr. au lieu de R. trichophyllus.
Thiébaud & Jeanmonod T06932 a été rattaché à Ranunculus trichophyllus en raison de ses feuilles relativement grandes et surtout du très faible nombre d'akènes. Mais il présente des pétales bien trop importants pour cette espèce et surtout des feuilles laminaires qui ne laissent aucun doute sur son appartenance à R. peltatus aggr. Cet individu est sans doute un hybride.
Analyse des «échantillons-test»
L'analyse des 10 «échantillons-test» montre que 5 individus ont été statistiquement attribués à plus de 95 % au taxon initial (tableau 4). Les autres ont un pourcentage d'attribution qui varie entre 60 et 86 %. Jeanmonod 8225 est le seul échantillon dont l'attribution ne permet pas de confirmer son affiliation finale à Ranunculus penicillatus aggr., les feuilles laminaires n'étant pas prises en compte dans l'analyse.
Jeanmonod J1479 a été aussi incorporé à l'analyse car cet individu sans feuilles laminaires collecté en 1985 avait été déterminé initialement comme Ranunculus trichophyllus. En 2019 cependant, 34 ans après, Jeanmonod J8212 a été récolté dans la même mare et il s'agit de R. peltatus aggr. (à feuilles laminaires). L'attribution à 97 % de la première récolte confirme qu'une espèce peut en remplacer une autre avec le temps, probablement suite à une dévastation brutale provoquée par des inondations.
L'attribution statistique à moins de 90% à un taxon peut être un signe d'hybridation et d'introgression entre taxons. C'est ce que nous soupçonnons pour 4 d'entre eux: Jeanmonod J8225, Thiébaud T04970, Litardière s.n. [18.III.1930] et Briquet s.n. [1.V.1907, Cateraggio]. Lambinon 92/21 enfin a été attribué à 68 % à Ranunculus peltatus aggr. Ce résultat est particulièrement intéressant car cet individu est dénué de feuilles laminaires (habituellement présentes chez ce taxon). La récolte datant du 24 mars, l'individu était sans doute trop jeune et n'avait donc probablement pas encore formé ses premières feuilles laminaires (voir sous «Développement, influence du milieu et écologie»).
Tableau 4.
Attribution initiale, statistique et finale des 10 «échantillons-test» sur la base de l'analyse discriminante des 77 individus de base. Les échantillons avec attribution statistique correspondant à plus de 95 % de celle supposée sont en gras. [Abréviations: * = peut-être hybridé; ** = car présence de feuilles laminaires; *** = individu non mature sans feuilles laminaires; Rpelt = Ranunculus peltatus aggr.; Rpeni = Ranunculus penicillatus aggr.; Rtric = Ranunculus trichophyllus Chaix]

Analyse des caractères
Le tableau 5 montre qu'à une exception près, soit le rapport entre la longueur de la feuille multifide sur celle de l'entrenœud correspondant [RAP_M/E], tous les caractères présentent des différences hautement significatives entre taxons selon le test de Kruskal-Wallis (P < 0,001). Ces résultats sont illustrés dans la figure 3.
L'analyse statistique des caractères montre que si 9 des 10 d'entre eux sont significatifs, ils présentent presque tous une variabilité telle que les extrêmes d'un taxon chevauchent souvent ceux des deux autres taxons. Cela signifie que l'observation d'un seul caractère s'avère généralement insuffisant et qu'il faut prendre en compte plusieurs d'entre eux à la fois.
Le meilleur caractère pour distinguer Ranunculus penicillatus aggr. de R. peltatus aggr. et R. trichophyllus est la longueur des feuilles multifides ainsi que celle des pédicelles fructifères et de l'entrenœud au niveau de la plus grande feuille. En présence de feuilles laminaires, la longueur de l'entrenœud au niveau du pédicelle fructifère sépare également parfaitement R. penicillatus aggr. de R. peltatus aggr. Si ces feuilles sont absentes, c'est la longueur des pétales qui est le meilleur caractère pour séparer R. penicillatus aggr. de R. trichophyllus.
Fig. 3.
Boxplot (représentation des médianes, premiers et troisièmes quartiles, ainsi que des valeurs extrêmes) des 10 caractères quantitatifs retenus pour les 77 individus attribués à Ranunculus peltatus aggr., R. penicillatus aggr. et R. trichophyllus Chaix.

Les caractères les plus discriminants permettant de séparer Ranunculus peltatus aggr. de R. trichophyllus sont la longueur des pétales, le nombre de fruits et le rapport longueur des pédicelles fructifères / entrenœud correspondant. Ces deux taxons se séparent aussi parfaitement sur la base de la présence ou l'absence de feuilles laminaires. Par ailleurs, Ranunculus peltatus aggr. est le taxon qui montre le plus de variabilité, alors que R. trichophyllus en présente le moins. Le nombre d'échantillons analysés est toutefois le plus élevé pour R. peltatus aggr. ce qui pourrait expliquer cette forte variabilité observée.
Taxonomie de Ranunculus sect. Batrachium en Corse
L'ensemble des observations, des analyses morphologiques et des analyses statistiques a donc permis de mettre en évidence la présence en Corse de trois taxons. Cependant les taxons inclus au sein de Ranunculus peltatus aggr. et de R. penicillatus aggr. n'ont pas été encore définis.
La distinction des taxons est peu évidente au sein de Ranunculus peltatus aggr. et la clé proposée par Wiegleb et al. (2017) ne permet pas de déterminer avec certitude les plantes corses. Une comparaison de la description de ces taxons (tableau 6) permet de constater que les plantes corses correspondent peu à R. peltatus s.str. mais plutôt R. saniculifolius en raison de la taille des feuilles laminaires, des feuilles multifides et des pétales. Ranunculus saniculifolius présente des réceptacles glabres à pubérulents et souvent une absence de feuilles multifides. En raison de ces derniers aspects, les plantes corses seraient plus proches de R. baudotii. Selon Wiegleb et al. (2017), certaines formes de R. saniculifolius ne sont pas distinguables de R. baudotii. Wiegleb (pers. comm.) estime même que ces deux taxons seraient conspécifiques. En conséquence, nous attribuons les plantes corses de R. peltatus aggr. à R. saniculifolius.
Tableau 5.
Statistiques élémentaires [moyenne ± écart-type] sur les 77 individus assignés aux trois taxons Ranunculus peltatus aggr. (43), R. penicillatus aggr. (18) et R. trichophyllus Chaix (16) et sur les 10 caractères quantitatifs retenus (voir tableau 2). Les degrés de liberté pour les tests sont mentionnés entre parenthèses carrées. [Abréviations: ns = P > 0.05; * = P < 0.05; ** = P < 0.01; *** = P < 0.001]

Parmi les 3 taxons reconnus au sein de Ranunculus penicillatus aggr., l'analyse permet d'exclure R. vertumnus à feuilles multifides courtes et de confirmer une forme avec feuilles laminaires (R. penicillatus, 12 individus) et une forme sans (R. pseudofluitans, 19 individus). En dehors de ce caractère, l'analyse ne permet pas de distinguer deux ensembles. De plus, l'observation dans une même population d'individus avec ou sans feuilles laminaires permet de conclure que les populations corses n'appartiennent qu'à un seul et unique taxon. Ce fait entre en contradiction avec le concept de Wiegleb et al. (2017) qui distingue deux espèces (R. penicillatus et R. pseudofluitans) sur la présence ou l'absence de feuilles laminaires, concept généralement accepté en zone tempérée. Cela n'est pas le cas en zone méditerranéenne où les deux taxons sont considérés comme synonymes (Pignatti, 1982, 2017; Cook, 1986; Arrigoni, 2006; Tison et al., 2014) ainsi que le confirme notre étude. Il est possible que l'interprétation de Wiegleb et al. (2017) soit trop restrictive et que R. penicillatus devienne fréquemment homophylle en Méditerranée et ne puisse être distingué morphologiquement de R. pseudofluitans. Il est aussi possible que R. penicillatus soit un taxon cryptique distinct des deux précédents, peut-être issu d'autres hybridations fertiles, difficilement distinguable morphologiquement des deux autres. Wiegleb (pers. comm.) estime d'ailleurs que R. penicillatus serait un agrégat formé de plusieurs espèces d'origine hybride, jeunes, n'ayant pas atteint leur état de coalescence et avec des morphologies se recouvrant. Cette interprétation va dans le sens des différences observées entre les zones tempérées et méditerranéennes. Nous en restons à l'interprétation de la plupart des auteurs ouest-méditerranéens en attribuant les populations corses hétérophylles ou homophylles à R. penicillatus.
Synthèse
Nos analyses combinées (observations sur le terrain, écologie, développement des plantes, morphologie et analyses statistiques) conduisent à ne reconnaître en Corse que la présence de trois taxons, soit Ranunculus saniculifolius, R. penicillatus et R. trichophyllus. Leurs morphologies cependant ne collent pas parfaitement avec celles retenues par Wiegleb et al. (2017). Une forte variabilité est observée chez ces trois taxons, notamment sur les caractères végétatifs. Celle-ci est attribuée en grande partie aux conditions locales et momentanées du milieu, entre les conditions de pleine eau et celles d'assèchements progressifs en cours de saison. De fait, certains rares individus sont difficiles à attribuer à l'une ou l'autre espèce car ils sont atypiques sur l'une ou l'autre caractéristique qui les font paraître comme plus ou moins hybrides. L'influence du milieu n'écarte toutefois pas cette hypothèse. Ces hybridations sont en effet assez fréquentes dans la section Batrachium selon Wiegleb et al. (2017), notamment pour les trois espèces en question. Les hybrides ne sont pas facilement reconnaissables sauf s'ils sont stériles, ce qui n'est pas toujours le cas. En Corse, les trois espèces sont rarement en contact les unes avec les autres. Cela semble être néanmoins le cas dans l'Ostriconi, à Solenzara, Porto-Pollo et Porto-Vecchio, là où justement une partie des individus atypiques et soupçonnés hybrides croissent (voir sous “Notes” dans le traitement de chaque taxon).
Tableau 6.
Comparaison de la description des taxons de Ranunculus peltatus aggr. selon Wiegleb et al. (2017), c'est-à-dire R. baudotii Gord., R. peltatus Schrank, R. saniculifolius Viv. avec les populations corses et leur attribution par caractère. [Abréviations: B = R. baudotii; P = R. peltatus; S = R. saniculifolius; flles lamin. = feuilles laminaires; flles mult.= feuilles multifides]

Malgré les nombreux travaux sur Ranunculus sect. Batrachium dans diverses régions du globe, plusieurs questions restent ouvertes. Comme le montre la présence de plusieurs espèces d'origine hybridogène, une évolution de type réticulé est à l'œuvre au sein de la section Batrachium avec des situations variables entre les diverses zones biogéographiques (notamment tempérées / méditerranéennes) impliquant des taxons cryptiques issus d'hybridations fertiles et d'introgressions encore mal comprises. L'interprétation taxonomique de ces taxons reste donc difficile, le choix du rang spécifique étant parfois une option problématique accentuant la difficulté de circonscrire et de définir correctement chacune d'entre elles. Par ailleurs, les morphologies particulières observées dans les diverses régions étudiées montrent que davantage d'attention devrait être portée au processus de dérive génétique. Enfin, les récentes découvertes sur l'importance des régulations épigénétiques modifiant le phénotype des populations en fonction des conditions du milieu (Balao et al., 2018) interrogent la notion d'espèce. Pour la section Batrachium où l'influence du milieu sur la morphologie est considérable, on peut poser l'hypothèse qu'une partie des espèces (actuellement reconnues) résulte des expressions épigénétiques d'une seule et même espèce.
Traitement taxonomique
Clef d'identification de Ranunculus sect. Batrachium en Corse
1. Feuilles toutes multifides 2
1a. Feuilles multifides et laminaires 3
2. Feuilles multifides les plus grandes > 6 cm de long (jusqu'à 13 cm); pétales généralement ≥ 6 mm de long; tiges généralement > 1 m de long (jusqu'à 5 m); pédicelles fructifères généralement ≥ 4 cm de long; plantes d'eau courante et profonde 1. R. penicillatus
2a. Feuilles multifides les plus grandes < 6 cm de long; pétales généralement ≤ 6 mm de long; tiges généralement < 0.8 m de long; pédicelles fructifères variables, généralement ≤ 4 cm de long; plantes d'eau faiblement courante et peu profonde 3. R. trichophyllus
3. Feuilles multifides les plus grandes ≥ 6 cm de long (jusqu'à 13 cm), à lanières souples s'orientant parallèlement dans l'eau, mais se mettant en pinceau hors de l'eau; tiges généralement > 1 m de long; plantes d'eau courante 1. R. penicillatus
3a. Feuilles multifides les plus grandes < 6 cm de long, à lanières plus ou moins rigides et en éventail dans l'eau comme hors de l'eau (parfois légèrement en pinceau hors de l'eau, selon les conditions); tiges généralement < 0,8 m de long; plantes d'eau plus ou moins stagnante 2. R. saniculifolius
1. Ranunculus penicillatus (Dumort.) Bab., Man. Brit. Bot., ed. 7: 7. 1874.
≡ Batrachium penicillatum Dumort. in Bull. Soc. Bot. Belg. 2: 216. 1863.
Holotypus: Belgique: «Flandre», s.d., Scheidweiler s.n. (BR).
Tige généralement allongée, 1–5 m de long, plutôt épaisse (2,5–5 mm de diam.) (fig. 1C–D). Feuilles laminaires parfois présentes et dans ce cas souvent peu nombreuses, suborbiculaires de 2–3 cm de diam., à 3 lobes divisés au 2/3 à 3/4, subentiers ou lobulés à crénelés; feuilles intermédiaires à lobules plus profonds parfois présentes, les multifides toujours présentes, (6–)7–10(–13) cm de long, généralement plus grandes que l'entrenœud correspondant, parfois subégales, rarement plus courtes, flasques, à lanières parallèles dans l'eau et se mettant en pinceau hors de l'eau. Pédicelles de (3–)4–10(–14) cm de long, souvent plus grand que la feuille correspondante, subégal à plus grand (jusqu'à 2,5 fois) que l'entrenœud correspondant, rarement un peu plus petit (0,8 fois). Fleurs à calice de 3–5 mm, teinté de bleu, à pétales de (4,5–)6–10(–11) mm de long, blancs et à onglet jaune, à nectaires lunulaires, parfois en gouttière. Réceptacle hérissé pubescent. Infrutescences de (4–)5–9 mm de diam. Akènes 15–60, de 1,4–2 mm de long, glabres.
Distribution, écologie et phénologie. – Ranunculus penicillatus est une espèce européenne présente surtout à l'ouest, plus rare à l'est selon Wiegleb et al. (2017). Elle est également présente en Afrique du Nord (Maroc) et introduite aux Canaries selon APD (2020). En Corse, elle est surtout présente sur les grands fleuves de l'ouest de l'île, tels que l'Ostriconi, le Fiume di Regino, Fiume Secco, Taravo, Baracci et Rizzanese, mais aussi sur quelques fleuves de l'est comme le Golo, le Stabiacciu, la Solenzara, ainsi qu'au sud, au ruisseau de Suala Vecchio. Elle est donc peu fréquente (fig. 4A) et subit des éclipses. Elle n'a en effet guère été revue récemment (Delage, comm. pers.) probablement à cause des fortes précipitations de ces dernières années qui ont tendance à purger brutalement les rivières et à faire disparaître les populations. Seul l'avenir nous dira si ces dernières ont réellement pu se maintenir.
Ranunculus penicillatus est présente dans les cours d'eau (fleuves, rivières, plus rarement fossés et ruisseaux) plus ou moins profonds (> 30 cm) et à eau courante, lacs, depuis le littoral jusqu'à 200 m d'altitude (mésoméditerranéen). Elle fleurit d'avril à juillet et fructifie dès fin avril.
Notes. – Les plantes typiques en pleine eau sont généralement robustes, mais les individus en bordure sont souvent plus fragiles et présentent des entrenœuds, des feuilles et pédicelles moins longs. Certains spécimens observés semblent être hybridés, tant avec Ranunculus saniculifolius (Jeanmonod J8223) qu'avec R. trichophyllus (Jeanmonod J8225). Les détails de ces spécimens sont disponibles dans le CHG (2021).
Spécimens examinés. – France. Haute Corse: Golo, Asco, 190 m, 15.VI.1919, Aylies s.n. (G); Lozari, Fiume di Regino, 20.IV.1907, Briquet et al. s.n. (G-BU); Ostriconi, 1 m, 20.IV.1907, Briquet et al. s.n. (G-BU); Calvi, Figarella, 5 m, 30.IV.2019, Jeanmonod J8221 (G); Ostriconi, 10 m, 1.V.2019, Jeanmonod J8223 (G); Ostriconi, pont de Trepide, 40 m, 1.V.2019, Jeanmonod J8224 & J8225 (G); Galeria, l'Argentella, 50 m, 7.V.1985, Jeanmonod & Roguet J2097 & J2097b (G); Aliborni, 5 m, 8.V.1985, Jeanmonod & Roguet J2160 (G); Lozari, Fiume di Regino, 10 m, 10.V.1985, Jeanmonod & Roguet J2266 (G); Ostriconi, 11.V.1985, Jeanmonod & Roguet J2290 (G); Algajola, 17.IV.1916, Kükenthal 1297 (G); Lumio, Fiume Secco, 2.VI.1988, Lambinon 88/98 (G); Calenzana, Fiume Secco, 100 m, 24.VI.1976, Lambinon & Duvigneaud L76/553bis (G); Algajola, 2.V.1911, Saint-Yves s.n. (G-BU). Corse-du-Sud: Figari, 14.IV.1983, Bosc s.n. (G); Propriano, Rizzanese, 13 m, 20.VI.2012, Desfayes s.n. (G); Propriano, Baracci, 19.V.1968, Greuter 8017 (G); Solenzara, 13.IV.1909, Houard s.n. (G); Portigliolo, 5 m, 28.IV.2019, Jeanmonod J8219 (G); Propriano, Rizzanese, 10 m, 24.IV.1985, Jeanmonod & Roguet J1347 (G); Porto-Vecchio, Stabiacciu, 3 – 4 m, 29.IV.1985, Jeanmonod & Roguet J1668 (G); Propriano, Rizzanese, 10 m, 7.X.1988, Jeanmonod & Roguet J4803 (G); Porto-Pollo, Taravo, pont Caitucoli, 1 m, 5.VI.1986, Jeanmonod et al. J3230 (G); Sartène, Pont de Rena Bianca, 2 m, 5.VI.1986, Jeanmonod et al. J3236 (G); Porto-Vecchio, Stabiacciu, c. 50 m, 4.VI.1988, Lambinon 88/123 (G); Sartène, Pont de Rena Bianca, 4.VI.1989, Lambinon 88/138 (G); Sartène, Pont de Rena Bianca, 10 m, 4.VI.1989, Lambinon 88/139 (G); Propriano, Rizzanese, 21.V.2000, Lambinon et al. L00/110 (G); Sartène, Pont de Rena Bianca, 10 m, 27.VI.1981, Thiébaud T02243 & T02243bis (G).
2. Ranunculus saniculifolius Viv., Fl. Libyc. Spec.: 29. 1824.
≡ Batrachium saniculifolium (Viv.) Dumort. in Bull. Soc. Bot. Belg. 2: 211. 1863. ≡ Ranunculus aquatilis subsp. saniculifolius (Viv.) O. Bolòs & Vigo in Butl. Inst. Catalana Hist. Nat., Secc. Bot. 38: 65. 1974. ≡ Ranunculus peltatus subsp. saniculifolius (Viv.) C.D.K. Cook in Anales Jard. Bot. Madrid 40: 473. 1983.
Holotypus: Lybie: «Habitat in inundatis salsis Magnae Syrteos», 1820, Bella Cella s.n. (GE†).
= Ranunculus baudotii Godr. in Mém. Soc. Roy. Nancy 1839: 21. 1839. ≡ Batrachium baudotii (Godr.) F.W. Schultz, Arch. Fl. Fr. et Allem.: 71. 1844. ≡ Ranunculus peltatus subsp. baudotii (Godr.) C.D.K. Cook in Anales Jard. Bot. Madrid 40: 473. 1983. Holotypus: France: «in rivulis propè Sarrebourg», s.d., Baudot s.n. (NCY).
Tige courte à peu allongée, généralement < 40 cm de long, plutôt fine (1–)2,5(–3) mm de diam. (fig. 1A–B). Feuilles laminaires toujours présentes à la fructification (sauf exceptions), suborbiculaires à subtriangulaires, de 0,7–2(–3) cm de diam., à 3–5 lobes divisés sur 1/3 à 3/4, lobulés à crénelés, parfois subentiers, souvent tachés de noir; feuilles intermédiaires parfois présentes, à lobules plus profonds et étroits, voire laciniés; les multifides presque toujours présentes, de 1–5,5 cm de long, plus courtes, subégales ou un peu plus grandes que l'entrenœud correspondant, plus ou moins fermes, à lanières étalées dans l'eau et ne se mettant pas en pinceau hors de l'eau. Pédicelle de 2–6(–15) cm de long, souvent plus grand que la feuille correspondante, parfois subégal à plus petit, plus grand (1,5–6 fois) que l'entrenœud correspondant et toujours plus grand que le pétiole de la feuille située au-dessus (rarement subégal). Fleurs à calice de 2–5 mm, teinté de bleu, à pétales de (4,5–)5–10(–12) mm, blancs et à onglet jaune, à nectaire lunulaire, parfois pyriforme. Réceptacle hérissé pubescent. Infrutescence de (4–)5–7(–9) mm de diam. Akènes 15–60, de 1,0–1,8(–2,2) mm de long, glabres ou plus rarement poilus.
Distribution, écologie et phénologie. – Ranunculus saniculifolius est une espèce méditerraneo-européenne dont l'aire s'étend jusqu'en Afrique du Nord et au Proche-Orient selon Wiegleb et al. (2017). Présente en Afrique du Nord, du Maroc (et Canaries) jusqu'en Egypte selon APD (2020). En Corse, cette espèce est présente dans tous les secteurs du Cap Corse à Bonifacio à l'exception du secteur de Renosu. Toutefois, elle semble être nettement moins répandue dans le centre-ouest de l'île, dans les secteurs du Cintu et du Rotondu où ce taxon doit être recherché. Ce dernier est nettement plus fréquent dans le sud de l'île (fig. 4B).
Ranunculus saniculifolius est principalement présente dans les mares et les zones humides, parfois dans des cours d'eau et fossés à eau peu profonde et courant très lent. Sa présence dans des mares temporaires lui fait souvent prendre une forme terrestre sans feuilles laminaires lors d'années sèches ou en fin de saison. Elle est généralement présente depuis le littoral jusqu'à 125–200 m d'altitude (thermo- et mésoméditerranéen), mais peut atteindre exceptionnellement 1200 m à la chapelle Sant'Alesio (supraméditerranéen). Cette station laisse penser qu'elle pourrait être aussi présente dans des mares du mésoméditerranéen supérieur et du supraméditerranéen. Ranunculus saniculifolius fleurit de mars à juin et fructifie dès avril.
Notes. – Ranunculus saniculifolius, en début de floraison, n'a souvent pas encore de feuilles laminaires et peut être donc parfois confondue avec R. trichophyllus. Il en est de même avec des individus terrestres avant la floraison. Ceux-ci se différencient par des pétales généralement plus grands (généralement > 5 mm de long), des feuilles multifides généralement plus longues que l'entrenœud correspondant, avec des divisions ultimes souvent plus courtes et moins fines que chez R. trichophyllus. Certains individus cités ci-dessous semblent s'être hybridés avec R. penicillatus (Aellen 2735, Lambinon 88/145) ou avec R. trichophyllus (Thiébaud & Jeanmonod T06932). Kralik s.n., très endommagé, a été attribué avec beaucoup d'incertitudes.
Spécimens examinés. – France. Haute Corse: Solenzara, Stagno di Chiola, 13.V.1935, Aellen 2734 (G); Stagno di Palo, 18.V.1935, Aellen 2735 (G); Stagno del Sale, 20.V.1935, Aellen 2733 (G); Tallone, gare, 5.V.1919, Aylies s.n. (G); Ostriconi, 20.IV.1907, Briquet et al. s.n. (G-BU); Tallone, Pont d'Arena, 20 m, 1.V.1907, Briquet et al. s.n. (G-BU); Barcaggio, 4.VI.1988, Dinter 1438a (G); Barcaggio, 0 m, 18.IV.1993, Gamisans 15666 (G); Solenzara, marais de Peri, 2 m, 2.V.1985, Jeanmonod & Roguet J1780 (G); Aleria, Teppe Rosse, 35 m, 2.V.1985, Jeanmonod & Roguet J1827 (G); Monticello, Pozzu d'Arbu, 100 m, 8.V.1985, Jeanmonod & Roguet J2255 (G); Poretta, Murotondo, 10 m, 15.V.1985, Jeanmonod & Roguet J2521 (G); Barcaggio, 5 m, 16.VI.1986, Jeanmonod & Zellweger J3638 (G); Désert des Agriates, Liscu, 30 m, 28.V.1986, Jeanmonod et al. J2788 (G); Barcaggio, 5 m, 16.VI.1987, Jeanmonod et al. J3782 (G); Désert des Agriates, Buggiu, 19.VI.1987, Jeanmonod et al. J3871 (G); Désert des Agriates, Guignu, 20.VI.1987, Jeanmonod et al. J3908 (G); Santa-Luciadi-Mercurio / Sermano, 1170 m, 29.V.2000, Jeanmonod et al. J6445 (G); Macinaggio, 24.III.1992, Lambinon 92/21 (G); Cateraggio marais de Padulone, 26.V.1952, Litardière s.n. (G); Bevinco, 19.IV.1956, Marchioni s.n. (G). Corsedu-Sud: Sta. Manza, 12.IV.1914, Brugère s.n. (G-BU); Bonifacio, 8.IV.1987, Corcelle s.n. (G); Solenzara, route de Bonifacio, 1.V.1912, Cousturier s.n. (G); Lavezzi, 1.V.1982, Deschâtres s.n. (G); ibid. loco, 1.V.1982, Deschâtres s.n. (G); Suartone, Tre Padule, 115 m, 13.V.1987, Gamisans 12935 (G); Ventilègne, Frasseli, 7.V.1990, Gamisans 14463 (G); Suartone, Tre Padule, 125 m, 8.V.1990, Gamisans 14466 (G); Lavezzi, 5.V.1992, Gamisans 15442 (G); Ventilègne, Frasseli, 20.IV.1993, Gamisans 15685 (G); Suartone, Tre Padule, 115 m, 7.V.2009, Gamisans s.n. (G); ibid. loco, 100 m, 20.V.1968, Greuter 8045 (G); Francolu entre Porto-Vecchio et Bonifacio, 25 m, 27.IV.2019, Jeanmonod J8212 (G); Ventilègne, Frasseli, 135 m, 27.IV.2019, Jeanmonod J8213 & J8214 (G); Bonifacio, Padulu, 80 m, 27.IV.2019, Jeanmonod J8217 (G); Monaccia d'Aullène, 5 m, 28.IV.2019, Jeanmonod J8218 (G); Porto-Pollo, étang de Tanchiccia, 5 m, 24.IV.1985, Jeanmonod & Roguet J1293 (G); Suartone, Tre Padule, 110 m, 29.IV.1985, Jeanmonod & Roguet J1609 & J1638 (G); Porto-Vecchio, Erbaggio, 3–4 m, 29.IV.1985, Jeanmonod & Roguet J1666 (G); Propriano, étang de Cannichia, 8 m, 5.VI.1986, Jeanmonod et al. J3192 (G); Porto-Pollo, pont D157, 5.VI.1988, Lambinon 88/145 (G); Etang de Pinarello, 3.IV.1938, Meylan 2373 (G); Belvédère-Campomoro, 4 m, 13.IV.2018, Mombrial FM01823 (G); Ajaccio, 1.V.1848, Requien s.n. (G); ibid. loco, 1.V.1848, Requien s.n. (G); Fontanaccia, 4.IV.1959, Stemmler s.n. (G); Ajaccio, 19.III.1909, Thellung s.n. (G); Cala di Roccapina, 3 m, 20.V.1982, Thiébaud T03231 (G); Ventilègne, Enna Longa, 90 m, 12.IV.1994, Thiébaud & Jeanmonod T06932 (G); Suartone, Tre Padule, 110 m, 19.V.1983, Thiébaud & Roguet T03797 (G); Ventilègne, Frasseli, 1.V.1982, Tison s.n. (Hb. Tison). Sine loco: Corse, 1850, Kralik, s.n. (G).
Fig. 4.
Cartes de répartition. A. Ranunculus penicillatus (Dumort.) Bab.; B. Ranunculus saniculifolius Viv.; C. Ranunculus trichophyllus Chaix. Les cercles correspondent aux individus homophylles terrestres attribués sans totale certitude.

3. Ranunculus trichophyllus Chaix, Pl. Vap.: 31. 1785.
≡ Batrachium trichophyllum (Chaix) Bosch, Prodr. Fl. Bat. 1: 7. 1850. ≡ Ranunculus aquatilis var. trichophyllus (Chaix) A. Gray, Manual, ed. 5: 40. 1867.
Neotypus: (désigné par Cook, 1966: 132): Suisse: «in aqua stagnante arde sub Kirchenfeld», s.d., Haller 1162 (G [G00441204]!).
Tige peu allongée (c. 30–60 cm de long) et plutôt fine (1–2,5 mm de diam.) (fig. 1E–F). Feuilles laminaires toujours absentes; les multifides toujours présentes, de 2–5,5(–6) cm de long, souvent nettement plus grandes que l'entrenœud correspondant, parfois subégales, rarement plus courtes. Pédicelle de 2–4(–6) cm de long, subégal à la feuille correspondante, parfois plus grand ou plus petit, souvent plus court que l'entrenœud correspondant. Fleurs à calice de 2–3 mm de long, teinté de bleu, à pétales de 4–6(–7) mm de long, blancs et à onglet jaune, à nectaire lunulaire, parfois pyriforme ou presque circulaire. Réceptacle hérissé pubescent. Infrutescence de 4–6 mm de diam. Akènes 15–40, de 1,3 à 2(–2,5) mm de long, glabres ou plus rarement poilus.
Distribution, écologie et phénologie. – Ranunculus trichophyllus est une espèce cosmopolite présente sur tous les continents, mais introduite en Afrique du Sud, dans les Andes, en Australie et en Nouvelle-Zélande (Wiegleb et al., 2017). En Corse, elle est peu fréquente et disséminée dans l'ensemble de l'île à basse altitude, notamment dans les secteurs de Tenda, Cintu, Plaine Orientale, Renosu, Incudine-Bavella, Ospedale-Cagna et Bonifacio (fig. 4C). Elle est présente dans les cours d'eau peu profonds (10–30 cm) et les fossés à eau courante, plus rarement dans les étangs. On la recense depuis le littoral jusqu'à 300 m d'altitude (mésoméditerranéen). Elle fleurit de mars à juillet et fructifie dès fin mars.
Notes. – La longueur foliaire varie parfois fortement notamment près ou très éloignées des fleurs (2–4 cm) et aussi sous l'eau (4–6 cm). Il ne faut pas confondre avec ce Ranunculus trichophyllus les exemplaires terrestres, à feuilles courtes et exclusivement multifides, qui peuvent aussi appartenir aux deux autres espèces. On peut néanmoins attribuer à R. trichophyllus les formes terrestres Aellen 4449 et Thiébaud & Jeanmonod T06883 du fait de leurs petits pétales.
Certains individus cités ci-dessous semblent s'être hybridés, tant avec Ranunculus penicillatus (Burnat et al. s.n. [11.VII.1906], Lambinon 89/135, Lambinon 91/332, Litardière s.n. [18.III.1930]) qu'avec R. saniculiolius (Briquet et al. s.n. [1.V.1907, Cateraggio], Jeanmonod J8220, Thiébaud T04970).
Specimens examinés. – France. Haute Corse: Solenzara, Pont de Travo, 27.VII.1933, Aellen 4449 (G); Solenzara, Stagno di Chiola, 13.V.1935, Aellen 2732 (G); Strette d'Omessa, Vignola, 15.V.1919, Aylies s.n. (G); Ostriconi, 20.IV.1907, Briquet et al. s.n. (G-BU); Cateraggio, 5 m, 1.V.1907, Briquet et al. s.n. (G-BU); Calvi, Piani, 5 m, 11.VII.1906, Burnat et al. s.n. (G-BU); Galéria, Fangu, 100 m, 5.V.1985, Gamisans 11480 (G); ibid. loco, 45 m, 29.IV.2019, Jeanmonod J8220 (G); Vallée de Lagani, 385 m, 1.V.2019, Jeanmonod J8226 (G); ibid. loco, 320 m, 1.V.2019, Jeanmonod J8227 (G); Solenzara, marais de Peri, 2 m, 2.V.1985, Jeanmonod & Roguet J1781 (G); Saint-Florent, Aliso, 5 m, 12.V.1985, Jeanmonod & Roguet J2420 (G); Saint-Florent, défilé des Strette, 10–20 m, 27.V.1986, Jeanmonod et al. J2754 (G); Vallée de Lagani, 280 m, 29.V.1986, Jeanmonod et al. J2856 (G); Pozo di Pedioco, 25 m, 30.V.1986, Jeanmonod et al. J2929 (G); Lumio, Fiume Secco, 2.VI.1988, Lambinon 88/99 (G); Pietralba, vallée de la Tartagine, 220 m, 11.VI.1989, Lambinon 89/135 (G); Barrage de Codole, 100 m, 21.VII.1991, Lambinon 91/332 (G); Calvi, Ficarella, 20.VII.1908, Litardière s.n. (G). Corse-du-Sud: Santa Manza, 29.III.1914, Brugère s.n. (G-BU); Porto-Pollo, étang de Tanchiccia, 5 m, 24.IV.1985, Jeanmonod & Roguet J1302 (G); Porto-Pollo, ruisseau d'Ortiesa, 90 m, 24.IV.1985, Jeanmonod & Roguet J1342 (G); Francolu entre Porto-Vecchio et Bonifacio, 1 m, 26.IV.1985, Jeanmonod & Roguet J1479 (G); Porto-Vecchio, 18.III.1930, Litardière s.n. (G); Ventilègne, Etang de Stagnolu, 3 m, 14.V.1984, Thiébaud T04970 (G); Cala di Conca, 1 m, 7.IV.1994, Thiébaud & Jeanmonod T06883 (G).
Remerciements
Nous remercions M. Desfayes, F. Mombrial et J.-M. Tison pour le don et le prêt de spécimens, ainsi que pour leurs informations et remarques. Tous nos remerciements vont également à A. Delage pour les informations qu'il nous a fournies et pour les discussions que nous avons partagées ainsi qu'à P. Clerc pour la relecture du texte et pour ses remarques avisées. Nous sommes également reconnaissants envers les deux experts le Prof. F. Muñoz et le Prof. G. Wiegleb pour leurs remarques constructives et les échanges qui en ont découlés. Finalement, nous remercions P. Bungener, M. Callmander, J. Calvo et A. Dos Ghali Negro pour leurs relectures attentives et commentaires divers qui ont permis l'amélioration du texte original.