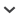O sagui-do-cerrado, Callithrix penicillata (Primates: Callithrichidae), é a menor espécie dentre os primatas do Brasil Central, pesando entre 350 e 500 gramas (Stevenson e Rylands, 1988), primitivamente uma espécie de Cerrado, ocupando matas de galeria, cerradões e cerrado strictu sensu (Bicca-Marques et al., 2006). Sua dieta é baseada em artrópodos, frutos, néctar e, principalmente, exsudates de plantas, sendo a espécie considerada gomívora-insetívora (Stevenson e Rylands, 1988). Primatas do gênero Callitrhix também são conhecidos por eventualmente forragear em ninhos de aves (Miranda e Faria, 2001; Lyra-Neves et al., 2007). Por exemplo, Mendes Pontes e Soares (2005) citam a predação por C. jacchus em ninhegos de pombo-doméstico (Columba livia domestica, Columbidae) e sabiá-laranjeira (Turdus rufiventris, Turdidae); Silva et al. (2008) relatam a predação de C. penicillata em uma rolinha-roxa (Columbina talpacoti, Columbidae); Begotti e Landesmann (2008), relatam algumas tentativas e predações de um grupo híbrido de C. jacchus e C. peniccilata em ovos da pomba-de-bando (Zenaida auriculata, Columbidae), do sabiá-barranco (Turdus leucomelas, Turdidae) e do sabiá do campo (Mimus saturninus, Mimidae). Nosso objetivo é relatar a predação de dois ninhegos da pomba-de-bando, Z. auriculata, por um grupo de C. penicillata na região noroeste do estado de São Paulo, onde a sagüi-do-cerrado é uma espécie introduzida.
Ao dia 08 de Agosto de 2008, por volta da 09:50 h. da manhã, ouvimos a agitação de um grupo de C. penicillata no jardim do estacionamento da Universidade Estadual Paulista-UNESP (20° 47′09.82 S, 49° 21′31.69″ O), Campus de São José do Rio Preto, interior de São Paulo. Ao nos aproximarmos, observamos um grupo de três indivíduos adultos em uma palmeira (Arecaceae). O grupo emitia guinchos e estava bastante agitado. Registramos em fotografia, um dos indivíduos, aparentemente um macho, com uma pequena ave morta nas mãos, a cerca de três metros de altura (Fig. 1). O sagüi se afastou dos demais, carregando a presa com a boca e, subiu para um galho mais elevado, a aproximadamente quatro metros do solo, consumindo-a sem dividi-la com os demais. Os outros membros do grupo ficaram guinchando e observando sua movimentação. Longe destes, sagüi manipulou a pequena ave, observando-a sob as asas e patas, como se estivesse buscando ectoparasitas; mordeu a cabeça e pescoço e, em seguida soltou-a ao chão. O grupo de C. penicillata então desceu da palmeira, correndo pelo chão até outra árvore, distante aproximadamente 8 metros, não sendo possível observá-los por mais tempo. Toda observação foi ocasional, não sendo parte de outro estudo e durou em torno de 10 minutos. Após o grupo de C. penicilata se afastar do local, nos aproximamos da palmeira e verificamos que se tratava de um ninhego de Z. auriculata . Na base da árvore observamos um segundo indivíduo morto e, assim como o primeiro, encontrava-se parcialmente predado, com apenas a região da cabeça consumida, sendo que todo o restante do corpo da ave encontrava-se inteiro e sem ferimentos. As aves apresentavam penugem juvenil, com muitas penas em desenvolvimento, sendo a primeira ave observada, menor que a segunda (120 mm. e 140 mm. de comprimento total, sem a cabeça, respectivamente). Verificamos um ninho na mesma árvore, possivelmente de onde os ninhegos foram obtidos. Adultos da ave não foram observados nas proximidades, mas a espécie é bastante comum na área, como pudemos constatar em observações anteriores.
Figura 1.
Indivíduo de Callithrix penicillata durante a predação do ninhego de Zenaida auriculata era São José do Rio Preto, noroeste de São Paulo, Brasil.

Espécimes de C. penicillata foram introduzidos por meio do tráfico ilegal para serem utilizados com animais de estimação (Begotti e Landesmann, 2008), nos estados do Rio de Janeiro e porção centro-sul de São Paulo (Olmos e Martuscelli, 1995; Bicca-Marques et al., 2006). Introdução de espécies não-nativas pode gerar competição interespecífica e transmissão de doenças à fauna nativa (Costa et al., 2005; Ruiz-Miranda et al., 2006; Mendes Pontes et al., 2007). O hábita de forrageio em ninhos de aves é conhecido para Callithrix, porém mais habitualmente sobre os ovos (Stevenson e Rylands, 1988, Miranda e Faria, 2001; Lyra-Neves et al., 2007). Argel de Oliveira (1995) cita que a predação de ninhos pode reduzir a riqueza e diversidade da avifauna local, e nossa observação corrobora a interferência negativa de espécies introduzidas na avifauna nativa. O fato observado pode ter sido um comportamento oportunista, não sendo necessariamente relacionado a limitações de recursos, visto que os indivíduos residentes na universidade já foram observados se alimentando de exsudatos, frutos ou sendo alimentados por seres-humanos. Nossa observação evidencia a importância destes pequenos mamíferos em uma série de importantes processos ecológicos (De Esteven e Putz, 1984; Fragoso, 1994), como a predação de espécies nativas e a competição com espécies sinantrópicas.
Agradecimentos
FBRG é grato a FAPESP (Mestrado proc. #07/52973-1) e ao CNPq (Doutorado proc. #145304/2009-4). RCLG é grata ao CNPq (Bolsa de Desenvolvimento Tecnológico Industrial do CNPq - Nível 7F, proc. #383268/2010-9) e (Mestrado proc. #134785/2011-8). Ambos agradecem a Empresa ATEND Ltda., pelo patrocínio e confiança em seus trabalhos.