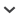This study reports an effective drug combination for the sedation of Priodontes maximus. Three captive adult giant armadilllos were sedated in 2010. The animals were kept at the Municipal Complex, Presidencia Roque Sáenz Peña (Chaco, Argentina). A combination of intramuscular anesthetic drugs (butorphanol, xylazine - midazolam) was applied under physical restraint. Isoflurane gas, delivered by facemask, was used for maintenance. The protocol allowed the safe handling of the animals, full physical exams, sample collection, and collection of vital parameters. The protocol was successfully reversed with naltrexone and yohimbine, and the animals recovered uneventfully.
Cuando se selecciona un método de contención física o química debe considerarse que el mismo proporcione máxima seguridad para el animal y las personas involucradas en su contención y que también permita llevar a cabo eficientemente el procedimiento propuesto (Fowler, 1986).
En muchas oportunidades se requiere sólo un estado de inmovilidad que permita la realización de procedimientos médicos (examen físico, colecta de muestras, examen radiográfico o curaciones) y/o de manejo (biometría, transporte o marcación) (Pachaly, 2000). Sin embargo, en muchos procedimientos la contención física no puede ser utilizada como único método sino que tiene que combinarse con drogas que permitan una anestesia o sedación del animal. Esta sedación e inmovilización permitirán la manipulación con un riesgo mínimo para el operador y el animal en cuestión.
Muchos medicamentos pueden ser combinados entre sí en asociaciones sinérgicas potenciadoras del efecto, resultando esto en una reducción del volumen total de los medicamentos utilizados y minimizando los efectos indeseados (Nunes et al., 2007). Adicionalmente, se han sintetizado productos antagónicos a algunos anestésicos que tornan aún más segura la intervención y posibilitan una reversión casi inmediata de los efectos producidos por los medicamentos anestésicos (Nunes et al., 2007).
Los xenartros presentan características anatómicas y fisiológicas únicas que se deben tener en cuenta cuando se inmovilizan animales de este grupo. Estos mamíferos son fácilmente afectados por cambios bruscos de temperatura (Divers, 1986; Nowak, 1991) dado que poseen bajas tasas de producción de calor, una alta conductividad térmica y una baja temperatura corporal (McNab, 1980, 1985).
Priodontes maximus (Xenarthra: Dasypodidae) es un armadillo que se distribuye desde el norte de Venezuela (este de los Andes) y Guayanas (Guayana Francesa, Guyana, Surinam) hacia el sur hasta Paraguay y norte de Argentina (Abba & Superina, 2010). Se encuentra listado en el Apéndice I de CITES y clasificado por la UICN como Vulnerable (Superina & Abba, 2010). Dentro de los armadillos, P. maximus es el de mayor tamaño; el largo de su cabeza y cuerpo ronda los 75–100 cm, su peso varía entre los 30 y 60 kg y presenta importantes garras en sus miembros anteriores que le permiten cavar profundas madrigueras. Su actividad es nocturna y a pesar de su aparente rigidez es un animal muy ágil (Nowak, 1999).
Debido a su tamaño y fuerza, es necesario sedar o anestesiar a P. maximus para poder hacer cualquier tipo de procedimiento. Esta especie es el único armadillo al que no se le puede dar contención física para poder colocar una mascarilla e inducir la anestesia mediante anestésicos inhalatorios (West et al., 2007).
Para la inmovilización química de distintas especies de armadillos se ha reportado, entre otros, el uso de tiletamina / zolazepam y ketamina sola o combinada con un sedante agonista alfa 2 (Deem & Fiorello, 2002; West et al., 2007); o tiletamina / zolazepam y ketamina / xilacina en Tolypeutes matacus (Orozco, 2011). Particularmente para P. maximus se ha reportado la utilización de combinaciones de ketamina / xilacina para su contención química (Gillespie, 2003). Sin embargo, el uso de ketamina trae consecuencias asociadas al tiempo necesario para la recuperación de la anestesia, sobre todo cuando se trabaja con animales silvestres.
Desarrollar protocolos anestésicos en un ambiente controlado y con animales acostumbrados a la manipulación, como lo son los mantenidos en cautiverio, permite llevar adelante procedimientos de sedación seguros. Estas condiciones son necesarias a la hora de realizar estudios a campo ya que permiten la obtención de muestras físicas y biológicas con el menor impacto sobre los ejemplares silvestres. Esta eficacia resulta en una recuperación rápida que permite devolverlos a su ambiente natural en el menor tiempo posible.
El objetivo de este trabajo fue evaluar una combinación de medicamentos anestésicos que permitieran alcanzar un estado de sedación profunda en P. maximus, seguida de una recuperación rápida y segura del animal por la reversión de la mayoría de los medicamentos usados. El grado de sedación debía permitir una contención física segura y posterior colocación de mascarilla para continuar los procedimientos bajo anestesia inhalatoria. Para ello se utilizó un protocolo diseñado en base a una combinación de medicamentos ensayada previamente en peludo (Chaetophractus villosus). El protocolo se diseñó en C. villosus por estar filogenéticamente relacionado con P. maximus y contar con varios ejemplares en el Bioparque de la Fundación Temaikèn (Belén de Escobar, Provincia de Buenos Aires, Argentina).
Durante tres meses se puso a punto un protocolo de sedación en C. villosus mantenidos en cautiverio en el Bioparque combinando diferentes fármacos a diferentes dosis (xilacina / butorfanol / midazolam) para lograr un grado de sedación profunda (resistencia física mínima a la manipulación) que permitiera el manejo. El protocolo desarrollado fue posteriormente extrapolado a los ejemplares de P. maximus. Finalmente se obtuvo una combinación de 1,2 mg/kg xilacina (Xilacina 100, Richmond, Vet Pharma, Buenos Aires), 0,4 mg/kg butorfanol (Butormin, Holliday-Scott S.A., Buenos Aires) y 0,2 mg/kg midazolam (Midazolan, Richmond, Vet Pharma, Buenos Aires), aplicados por vía intramuscular, que logró el efecto deseado. Para la reversión de los efectos de las drogas se aplicó 0,25 mg/kg naltrexona (Naltrexone HCL, Wildlife Pharmaceuticals, Windsor, CO, EEUU) y 0,125 mg/kg yohimbina (Yohimbine, Richmond Vet Pharma, Buenos Aires) por vía endovenosa.
En mayo de 2010 se realizó el procedimiento en tres ejemplares adultos de P. maximus mantenidos en cautiverio en el Complejo Ecológico Municipal, Presidencia Roque Sáenz Peña (Provincia de Chaco, Argentina). Los tres individuos fueron pesados antes de comenzar el procedimiento con un dinamómetro digital (±0,1 kg) (hembra 1: 39,0 kg; hembra 2:47,0 kg; macho: 47,5 kg). Para el procedimiento se realizó una breve contención física de los animales sujetándolos del caparazón, por detrás, a la altura de las bandas móviles. Esta contención permitió la aplicación intramuscular (IM), en uno de sus miembros posteriores, de una combinación de medicamentos correspondiente al protocolo determinado en relación al peso de cada individuo. Durante el procedimiento se registraron en planillas el tiempo que llevó alcanzar el plano de sedación profunda y se observaron las respuestas de los ejemplares a la misma. Una vez alcanzado el plano de sedación requerido los animales fueron transportados alrededor de 50 m en camilla desde el recinto hasta el hospital veterinario donde se continuó el procedimiento con anestesia inhalatoria (Fig. 1). Para ello se administró isoflurano (Isoflurane, Nicholas Piramal India Ltd, Bombay, India) con mascarillas, utilizando un porcentaje anestésico de entre 2,5% y 1% según la necesidad de profundización anestésica, con un flujo de oxígeno de 7 l/ min. En todos los casos se colocó un catéter 20G en la vena safena interna con goteo de solución Ringer Lactato a razón de 20 ml/kg/h durante los primeros 20 min y luego se continuó con 10 ml/kg/h. Durante la anestesia con isoflurano se registraron datos de frecuencia cardíaca y frecuencia respiratoria.
Figura1.
Priodontes maximus anestesiado por la administración de isoflurano, mediante mascarilla inhalatoria, para control clínico.

Los procedimientos duraron alrededor de 40 min desde la aplicación del sedante IM hasta que se puso en cero el vaporizador anestésico. Se realizó identificación, chequeo clínico general y extracción de sangre para análisis hematológicos, de hemostasia, bioquímica sanguínea y hemoparásitos (por tinción de frotis de sangre periférica). Una vez finalizado el procedimiento y puesto en cero el vaporizador anestésico se realizó la reversión de los medicamentos según el protocolo descripto previamente. Se registró, a partir de realizada la reversión, la respuesta del animal y el tiempo de recuperación.
Los tres ejemplares de P. maximus alcanzaron un plano de sedación profunda antes de los 5 min siguientes a la aplicación de la combinación de drogas establecida (protocolo de sedación). El macho y la hembra 2 presentaron miembros relajados, sin ofrecer ningún tipo de resistencia a la contención física luego del efecto de la sedación. La hembra 1 presentó leves movimientos de sus miembros anteriores aunque esto no impidió que pudiera ser manejada.
La frecuencia cardíaca registrada en promedio entre los tres animales fue de 54,8 (rango 48–60) latidos/min y la frecuencia respiratoria registrada en promedio fue de 8,7 (rango 4–20) respiraciones/ min. El macho y la hembra 2 presentaron bradipnea (frecuencia respiratoria 3 respiraciones/min) durante el procedimiento con anestesia inhalatoria, posiblemente por profundización anestésica al combinar el anestésico inhalado junto a los medicamentos sedantes. En ambos casos se revirtió parcialmente la xilacina utilizando un cuarto de dosis total de yohimbina como reversor antagonista específico de la xilacina, administrada por vía endovenosa. Como respuesta se observó un incremento de la frecuencia respiratoria en promedio a 12 respiraciones/min dentro de los 3 min posteriores a la aplicación de la yohimbina.
Luego de 5 min de administrada la reversión de los sedantes a través de sus antagonistas específicos, se observó que los tres ejemplares se encontraron de pie, con la cabeza levantada y los ojos abiertos, moviéndose con fuerza y alertas.
Se recomienda la administración de fluidos vía parenteral mediante el uso de un catéter endovenoso para contrarrestar los posibles efectos de hipotensión que se pudieran presentar debido al uso de medicamentos como la xilacina e isoflurano.
Se puede concluir que la combinación de medicamentos y las dosis obtenidas a partir de un protocolo diseñado durante ensayos previos en C. villosus servirían para lograr un grado de sedación para P. maximus que permita una manipulación segura tanto para el animal como para las personas involucradas en el procedimiento. Es necesario continuar realizando experiencias para aumentar el número de casos exitosos y continuar ajustando el protocolo para evitar la bradicardia observada y aumentar el número de ejemplares tratados con este protocolo.